产品中心
在生物制药质量控制体系中,宿主细胞蛋白(HCP)残留检测是确保产品安全性的核心环节之一。作为行业主流方法,ELISA技术的选择与应用涉及技术、法规、成本等多重因素考量。
本文基于USP <1132>、EP <2.6.34>等权威指南,系统阐述ELISA检测HCP的优势与局限性,为研发、质量相关人员提供技术评估与规划的参考依据。
01 ELISA检测HCP的核心技术优势
• 检测灵敏度与定量能力
ELISA方法的定量下限(LLOQ)一般可达到ng/mL。例如,对于典型的主蛋白浓度为10 mg/mL的产品,灵敏度可低至0.1 ng/mg(0.1 ppm)。相比电泳技术、液相等方法,具有显著优势,可满足生物制剂的严苛放行标准。
• 高通量与低成本
支持96孔板大规模样品检测,配合自动化液体工作站可实现快速、准确的样品检测,数据重现性好。相较于质谱(LC-MS/MS),单次检测成本仅为其1/10,适合作为工艺监控和批放行的常规手段。
• 法规认可度高
○ USP <1132>明确将夹心ELISA定为HCP检测的金标准;
○ EP <2.6.34>将其列为推荐方法;
○ ICH <Q6B>接受经充分验证的ELISA数据作为放行依据。
• 良好的动态范围适配性
采用多克隆抗体(pAb)可识别数百至上千种HCP,可覆盖从原液到成品的全流程HCP残留监控,为工艺清除能力评估提供整体视角。
02 实践局限性深度剖析
局限性1:HCP ELISA的检测值本质是免疫学当量(Immunological equivalents)而非真实质量水平
HCP ELISA检测的本质是通过抗体-抗原结合信号强度,借助HCP校准品,来反映样品中HCP的相对含量,而非HCP的实际质量浓度。因此,HCP中存在的高免疫反应性蛋白(如免疫佐剂类HCP)即使微量也会产生强信号,而弱免疫反应性蛋白或未被免疫覆盖的HCP可能完全漏检。法规建议通过使用不依赖HCP免疫反应性检测的正交方法(Orthogonal methods)交叉验证,避免单一方法盲区,例如CE或LC-MS/MS方法,以辅助确认ELISA方法的有效性。
表1.Results from a generic commercial ELISA, a validated platform ELISA, and LC-MS analysis of seven drug substance GMP batches. The total HCP content is measured in parts per million (manograms (ng) HCP per milligram (mg) drug substance)[1]
Total HCP amount(ppm,ng/mg) | |||
Batch ID | Generic commercial ELISA | Platform ELISA | LC-MS |
1 | 10 | 123 | 236 |
2 | 5 | 32 | 182 |
3 | 4 | 26 | 282 |
4 | 5 | 116 | 392 |
5 | 171 | 439 | |
6 | 229 | 352 | |
7 | 211 | 345 | |
局限性2:抗体覆盖率(Coverage)是最大技术风险点
HCP抗体的覆盖程度直接决定方法有效性。例如在平台型方法的使用中,其抗体可能无法识别新工艺产生的独特HCP谱。
某产品工艺从含血清培养转为无血清培养时,原平台型抗体对新增HCP无识别能力,可能导致假阴性放行。
USP<1132>和EP<2.6.34>等要求通过特定方法证明抗体能识别“绝大多数HCP”,尤其是潜在高风险HCP的能力,目前实际文献报道覆盖率通常在60-70%水平。
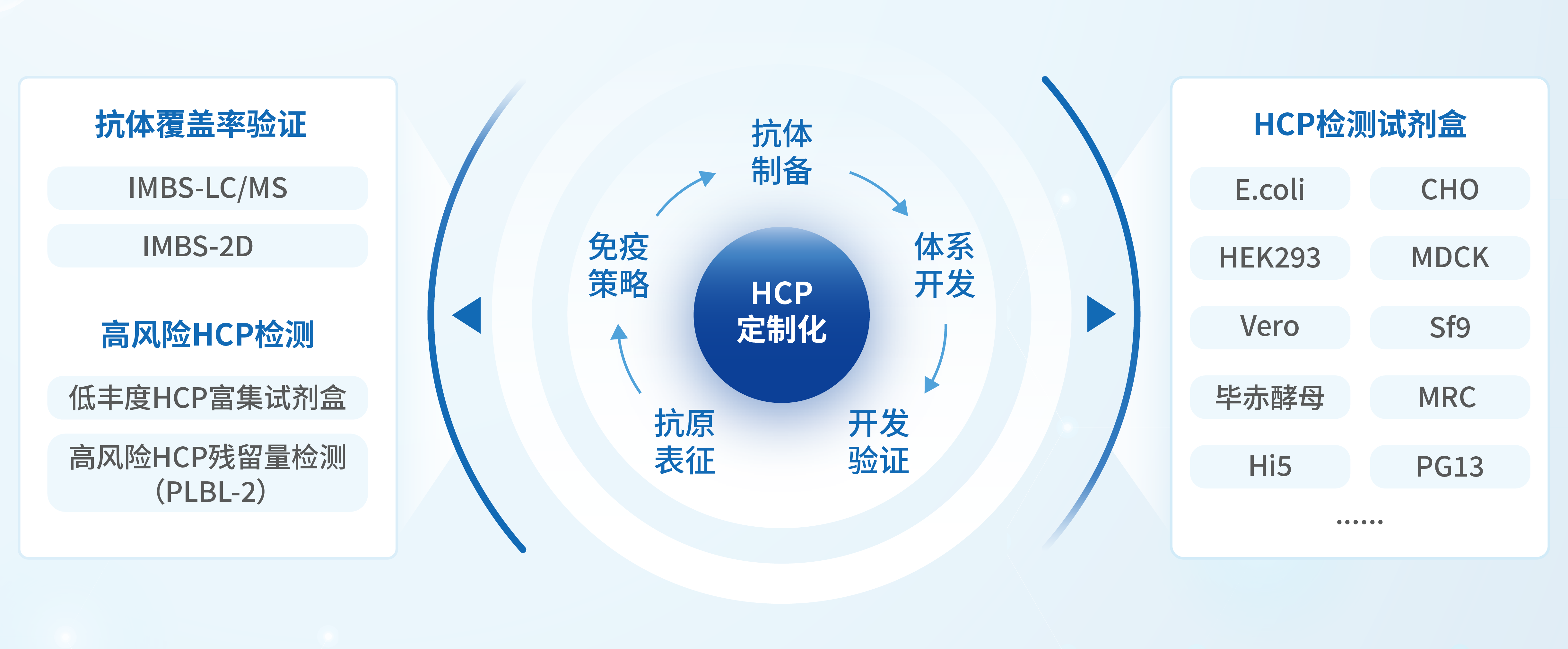
因此,提升HCP抗体的覆盖率以及选择良好的评估抗体覆盖率的技术方法尤为关键。湖州申科开发的成熟商业化试剂盒和定制开发服务,是基于多种抗体制备策略,例如抗原分级策略,构建针对不同层级HCP的抗体池,并择取最具普适性的抗体方案,在样品适用性上获得了良好的体现。
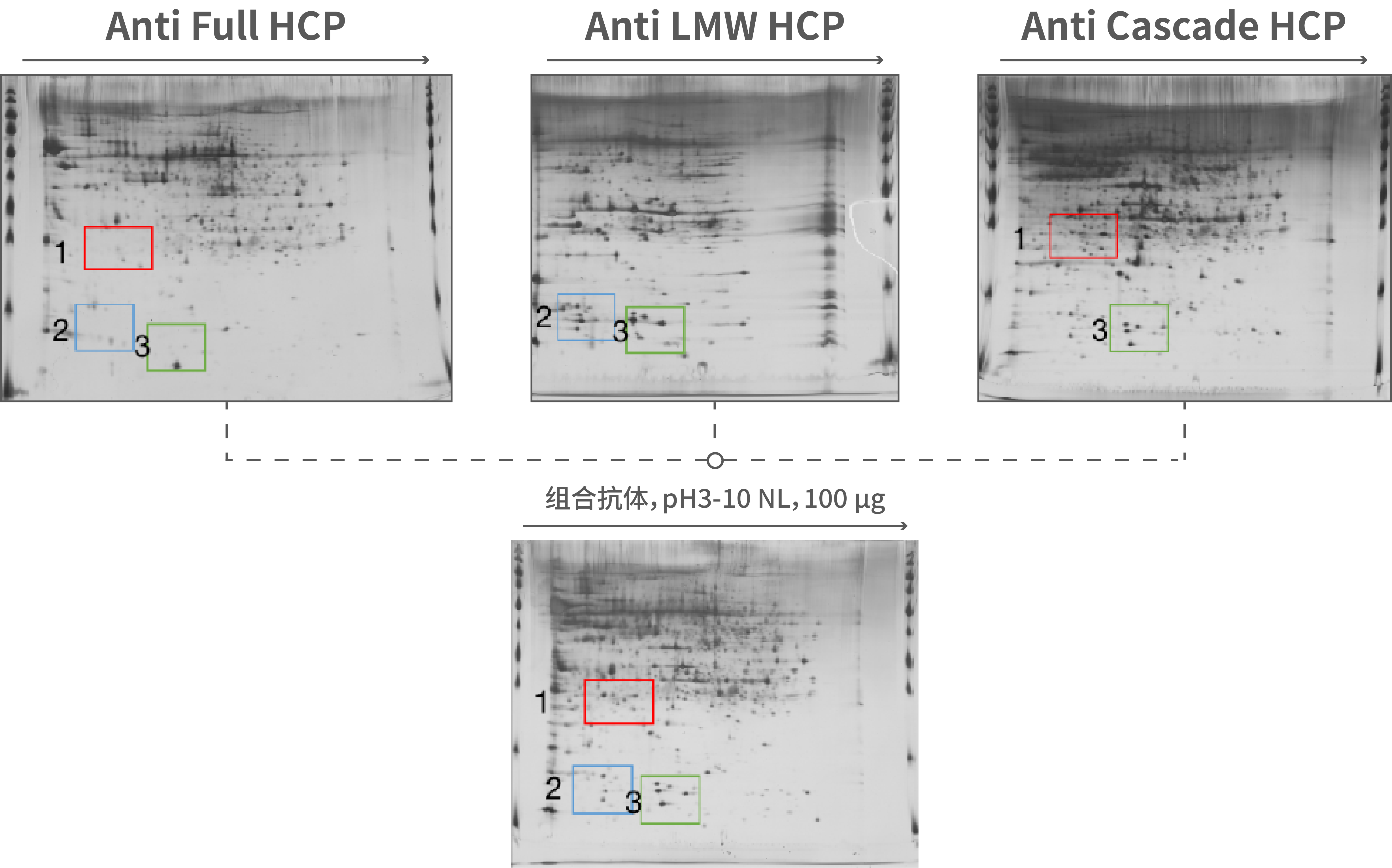
图1.湖州申科案例:多种策略抗体池的覆盖率表现
基于风险管理理念,HCP抗体能真实识别HCP中风险性蛋白的能力更加重要。因此,湖州申科建立了成熟的基于磁珠法抗体免疫捕获和质谱分析平台(IMBS-MS),能够充分表征HCP抗体,证明其识别风险性HCP的能力,已成功服务客户用于国内外申报,满足当前监管的要求。
局限性3:校准品与实际样品的HCP不匹配
即使采用平台型试剂盒,其HCP校准品多来自于无产品基因的细胞(Null cell),而实际样品中的HCP来自表达产品的细胞(Production cell),二者HCP谱可能会因产品表达压力、代谢负荷不同而存在差异。EP <2.6.34>规定校准品必须代表预期生产过程,但实践中只能尽可能接近。
湖州申科HCP ELISA开发过程中,校准品基于广泛的客户特定样品,具备良好的广谱性,通过质谱方法确认与客户样品存在良好的一致性,确保满足法规要求与检测可靠性。
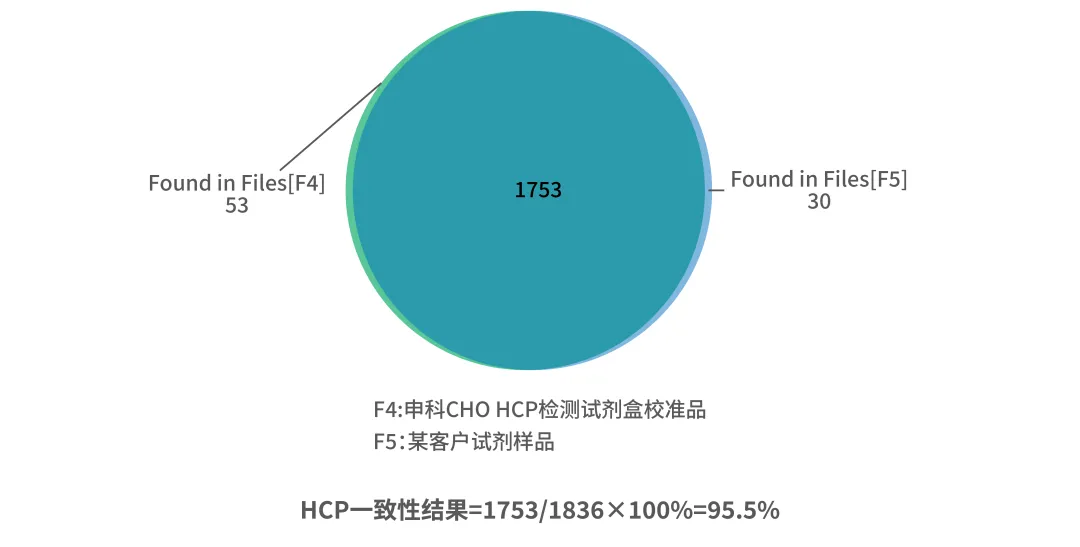
图2.湖州申科案例:客户真实工艺样品与试剂盒校准品的质谱对比分析
局限性4:无法鉴别特定的HCP(Individual HCP)
ELISA方法仅提供总量数据,无法识别具体是哪种HCP残留,也无法评估单个HCP的风险等级(如免疫原性、生物学活性)。法规建议采用LC-MS/MS进行HCP鉴定,特别是对已报道的高风险蛋白(如蛋白酶、细胞因子同源物)进行识别鉴定,并且有针对性的工艺优化或者重点监控。
湖州申科依托已验证的LC-MS/MS平台,针对客户特定样品进行异常HCP的深度表征,为试剂盒选择与方法学验证提供关键科学依据。
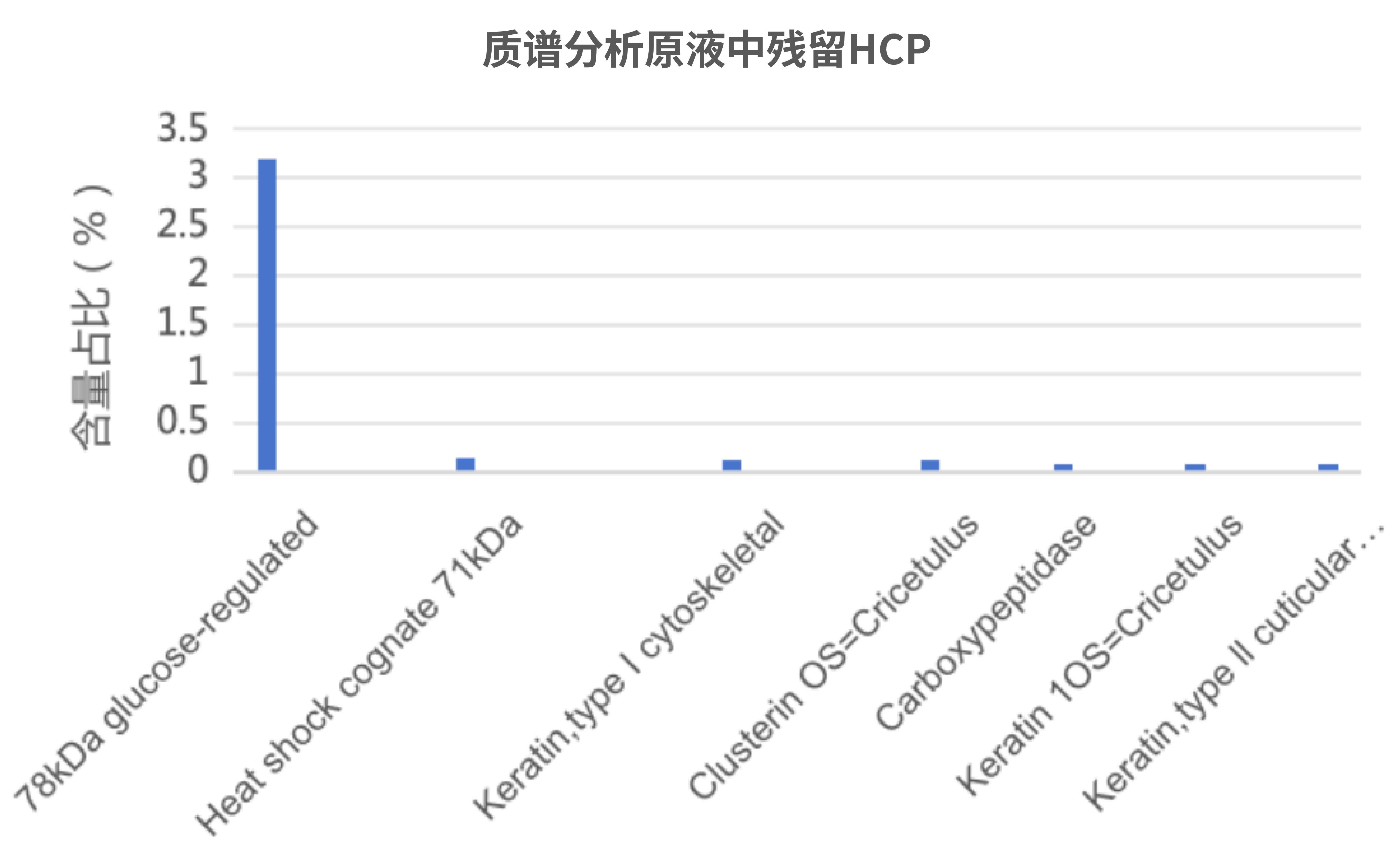
图3.湖州申科案例:客户样品中HCP残留鉴定和含量测定
法规要求对于原液中残留的高风险蛋白,需要对应的检测方法进行单独监控,常用ELISA方法或质谱定量方法。湖州申科针对目前CHO来源公认的高风险因子,推出了CHO HCP高风险蛋白PLBL-2检测试剂盒(1301315)等系列产品,用于过程控制与放行检测,全面满足监管合规性要求。
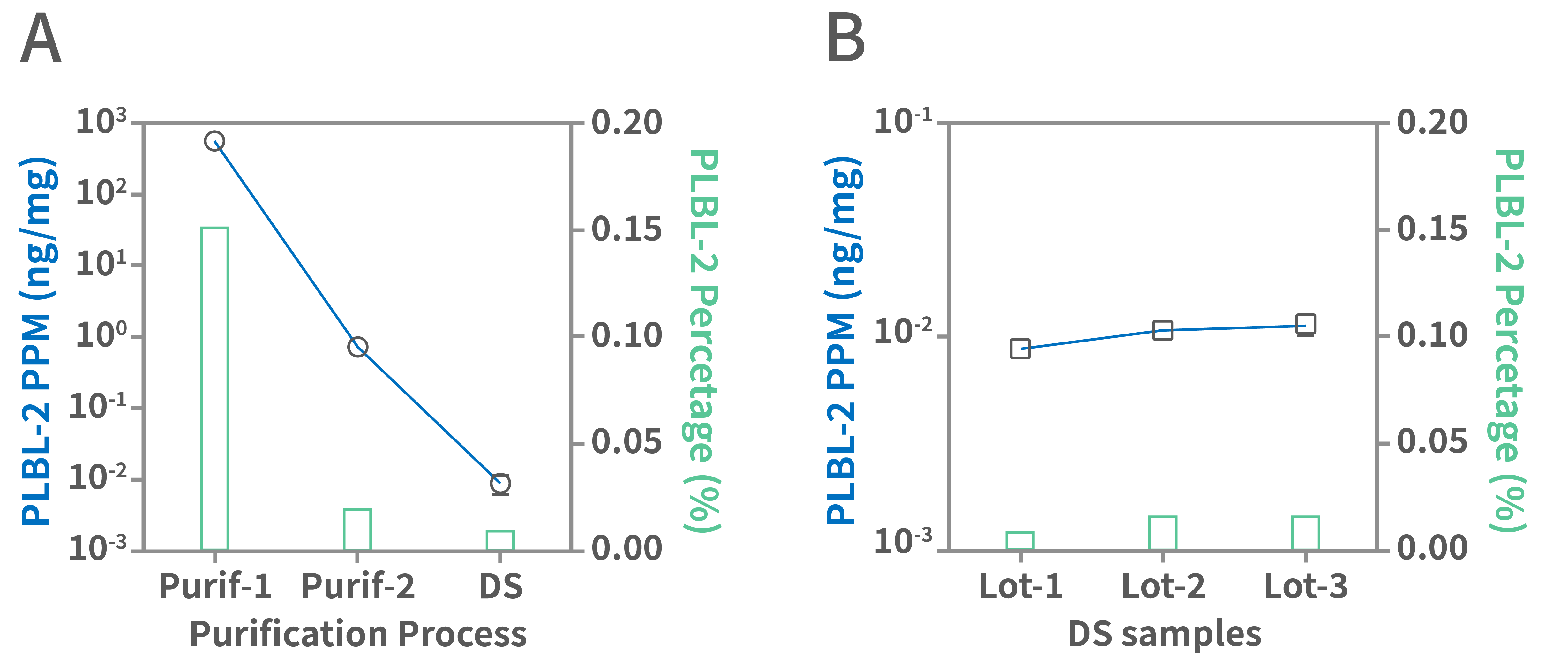
图4.湖州申科案例:PLBL2 ELISA在客户的过程样品和多批次原液样品中检测结果
ELISA虽仍是HCP检测的金标准,但并非完美的HCP检测方法。在当前技术条件下,它是平衡灵敏度、通量、成本的最优解。目前应用的关键在于正视其局限性,通过严谨的方法学设计、系统的验证策略和持续的生命周期管理,将风险降至最低。因此,当前对于HCP的总体控制策略—ELISA+LC-MS/MS双平台策略已是业内趋势,建议尽早布局运用。
湖州申科提供针对HCP检测的全套解决方案和服务,涵盖高性能ELISA试剂盒、抗体开发服务、样品适用性验证、覆盖率验证、抗原一致性评估、高风险蛋白鉴定与定量及日常样品检测,旨在为生物制药客户提供从工艺开发到质量控制的全方位支持。我们的产品和服务不仅提供可靠的定量分析工具,还通过定制化服务和验证支持,帮助客户优化生产流程、降低风险并确保符合监管要求。
参考文献:
[1] Monitoring process-related impurities in biologics-host cell protein analysis.