产品中心
欧洲药典(EP)11.8 新增了“5.1.13 热原性”通则,正式以单核细胞活化试验(MAT)取代沿用多年的家兔热原检测(RPT),并明确要求企业在产品放行检测中优先采用 MAT。这一变革标志着欧洲药典全面实现热原检测从动物试验向体外方法的转型,不仅符合全球推行的动物福利与“3R”原则,也顺应了新方法体系(New Approach Methodology,NAM)在药物开发中的发展趋势。
01 全球监管协同:MAT 从“可选”到“必选”
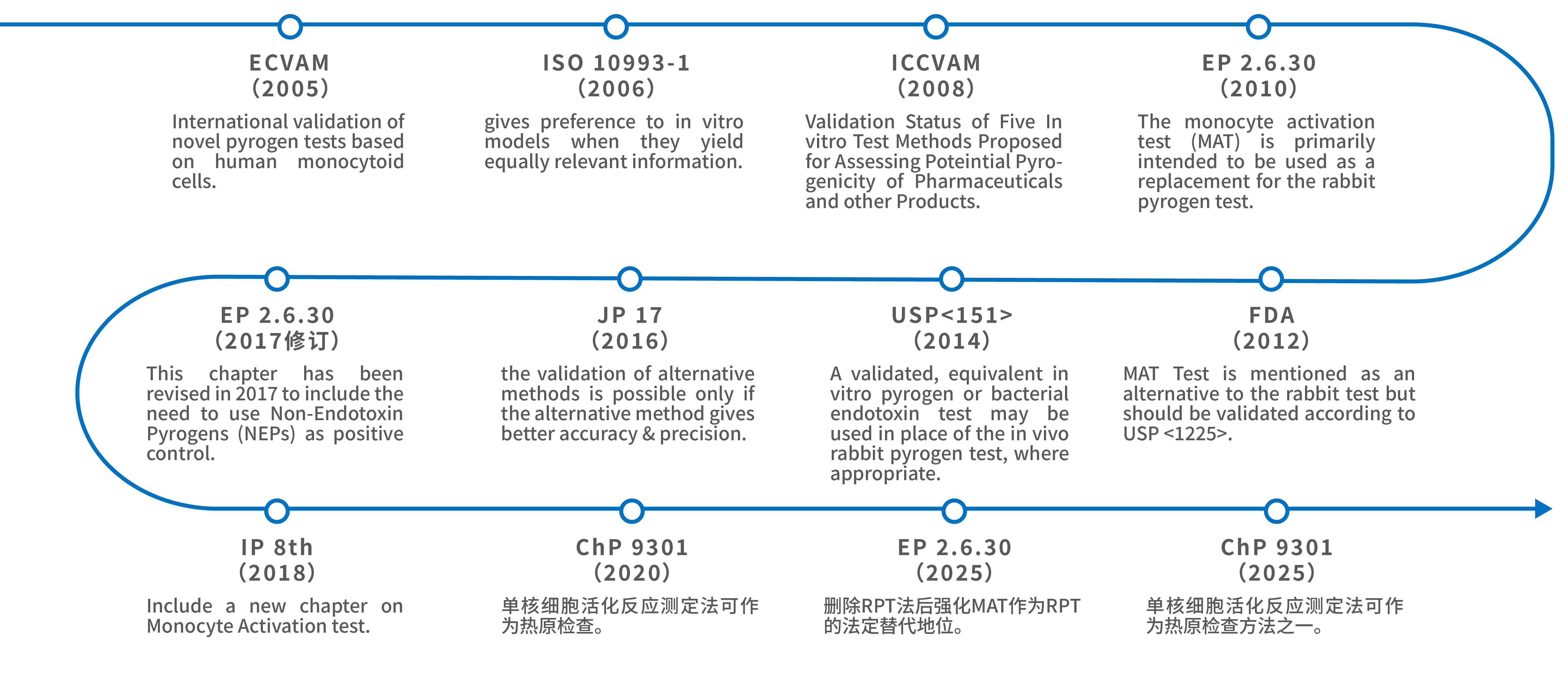
自2010年被纳入欧洲药典作为替代方法(EP 2.6.30)以来,MAT 已逐步成为评估各类热原的公认方法。美国 FDA、美国药典(USP)、俄罗斯及欧亚药典等均已认可 MAT 作为药典方法或替代方法。中国药典也从2020版起将其列为补充方法,并在2025版中进一步明确相关要求,体现与国际规范的协同。
此次法规更新,意味着在欧盟上市或销售的注射剂、生物制品及医疗器械企业必须:
• 方法转型:尽快建立并验证 MAT 检测能力,或委托具备资质的机构进行;
• 文件更新:修订注册档案中的质量控制方法及相关 SOP;
• 合规申报:根据指南要求提交相应类型的变更申请。
从长远看,这次变革是欧洲减少动物试验整体监管策略的一部分,预示体外检测方法将成为未来主流。
02 EP 11.8 中 MAT 的核心更新要点
EP 11.8 在 MAT 的标准化、质量控制和结果接受标准方面进行了细致修订,主要涵盖以下几点:
• 明确细胞系要求:推荐使用经鉴定的单核细胞系,其具备标准化、可大规模生产和稳定性高等优势,能同时检测内毒素与非内毒素热原(NEP)。
• 细化 NEP 对照:增强对非内毒素热原检测结果的多重解读能力。
• 优化结果判读:对梯度稀释结果的接受标准更为审慎,提升检测可靠性。
• 标准曲线灵活化:允许使用不同类型的标准曲线,并明确了可接受标准。
对比维度 | EP11.0-2.6.30 | EP11.8-2.6.30 | 25版ChP-9301 |
检测方法 | 定量&半定量&参考批次比较 | 半定量&参考批次比较 | 定量 |
单核细胞系 | 适用于细菌内毒素的检测,但用于检测非内毒素热原的用途有限 | 除能检测细菌内毒素外,还可检测非内毒素性促炎或致热性污染物 | 无 |
检测限(LOD)/测试灵敏度 | 即为临界值所对应的内毒素浓度 | 即标准曲线上响应值超过临界值的最低内毒素参考标准浓度。 | 即标准曲线上响应值超过临界值的最低内毒素参考标准浓度。 |
最大有效稀释倍数(MVD) | CLC*c/LOD | CLC*c/检测灵敏度 | CLC*c/LOD |
标准曲线:空白OD值 | <0.1 | OD值尽可能低 | 无 |
标准曲线:可接受标准 | 反应的回归统计学显著性(p < 0.01) | 已删除 | 反应的回归统计学显著性(p < 0.01) |
标准曲线:R2 | 无 | R2>0.975 | r≥0.90 |
标准曲线: 用于回归分析的浓度数量 | 至少4个浓度 | 至少4个浓度线性拟合 至少5个浓度为四参数拟合 至少6个浓度为五参数拟合 | 至少4个浓度 |
加标NEP回收率 | 无 | 有效测试:50%<回收率<200% 无效测试:回收率<50% 协同效应:回收率>50% | 无 |
样本的稀释倍数 | 确定的最低稀释度开始进行2倍稀释(不超过MVD) | 确定的最低稀释度开始进行几何稀释(不超过MVD) | 确定的最低稀释度开始进行2倍稀释(不超过MVD) |
结果判断-加标回收率 | 3个连续稀释梯度下必须满足50-200%间 | 至少有一个稀释梯度满足回收率在50-200%间,检测结果可以判断有效 | |
结果判断-CLC | 3个连续稀释梯度热原检测值不超过样品的CLC | ||
如需更详细的法规解读资料,可联系我们获取专题 PPT
03 高效推进 MAT 验证的关键步骤
MAT 作为欧洲药典收录方法,企业在使用时无需进行全方法验证,只需开展样品适用性验证,主要内容包括:
• 内毒素标准曲线合格;
• 测试溶液不影响 IL-6 表达;
• ELISA 对 IL-6 定量无干扰;
• 能有效检出非内毒素热原。
当然,所选用的 MAT 试剂盒供应商应已完成符合 ICH Q2(R2) 要求的全面性能验证,包括线性、范围、检测限、精密度、专属性等指标。

在 EP 框架下采用 MAT,企业可大幅节约前期验证投入,将资源集中用于产品特异性验证,实现科学、合规与效率的平衡。
04 企业应对指南:从 RPT 转向 MAT
检测方法的变更为强制性要求。若现有上市许可文件中仍包含家兔热原试验,企业应主动发起变更,删除该试验并评估是否需引入替代方法。
EMA 在相关问答中建议:
1. 若申报资料中已包含适当方法并获批准,可提交 IB 类变更 删除 RPT,并附上风险评估。
2. 若采用替代方法,则根据方法类型判断:药典细菌内毒素方法属 IB 类,药典 MAT 或非药典体外方法属 II 类变更。
05 关于湖州申科 PyroSup™ 热原检测试剂盒(MAT法)
湖州申科推出的 PyroSup™ 热原检测试剂盒(MAT法),联合权威机构完成全面性能验证,同时符合 EP 11.8(2.6.30)与 USP <1225> 要求,助力企业满足欧美申报需求。
产品特点:
• 细胞来源合规:获 ATCC 授权,溯源清晰,申报无忧;
• 监管认可:经系统验证,质量与性能优于同类产品;
• 适用性广:覆盖抗体、疫苗、血液制品、中药注射剂、医疗器械、化药、原辅料等;
• 成功案例:国内首家完成欧盟 EP 家兔法热原检测替换的企业合作伙伴。