产品中心
宿主细胞蛋白(Host cell proteins,HCPs)是生物制品中一种重要的工艺杂质之一,由于其潜在的诸多危害,往往作为关键质量属性之一进行质量控制。
目前按照中国药典、美国药典和欧洲药典等各国药典和ICH Q6B等法规要求,可采用高检测灵敏度和良好特异性的双抗体夹心法进行快速检测,包括酶联免疫吸附法,化学发光免疫法等多种形式,此处统称HCPs免疫检测法——目前该方法是HCPs残留检测定量分析的常用方法,广泛用于生物制品早期工艺开发,后期工艺验证和日常批放行检。
HCPs是一种多蛋白质混合物,其蛋白种类和丰度,蛋白翻译修饰(PTM)等变异度大,因此检测方法的开发难度较大。由于HCP的复杂性,各国监管机构实际也没有对其规定统一的标准,需要按照实际产品进行分别控制。
在实际的操作过程中,我们发现不同生产商的商业化通用型试剂盒之间的检测结果往往存在差异,通用型和企业自备的工艺特异型之间也存在较大的差异,本文从HCPs免疫检测法开发角度,尝试对其原因进行简单的分析,供大家参考。
从双抗体夹心免疫检测方法的原理考虑,获得一个性能优异的检测方法最重要的是把握三个要素:校准品、抗体、检测体系。
HCPs校准品的制备
HCPs免疫检测法作为一种外标定量分析方法,样品中HCPs的检测值是通过校准品进行校准和计算的,因此校准品的选择和制备无疑是第一步,也是不同试剂盒之间比较的基础之一。HCPs校准品往往也同时作为抗体制备的免疫原,因此校准品是方法开发的首要决定因素,需要进行充分研究和表征分析。
HCPs校准品来源及制备方法:
生物制品生产工艺比较复杂,如图1所示,典型的工艺流程包括上游培养发酵工艺和下游多步纯化工艺,其中HCPs主要在下游工艺中逐步进行去除,如单抗药类产品在proteinA纯化步骤的清除率可达到90%以上。大量研究发现,不同的细胞基质,不同培养工艺,不同纯化工艺,不同产品蛋白等因素均会引起HCPs蛋白谱的差异。如图1所示,不同工艺阶段获取的HCPs种类差异大,适合不同的检测需求。
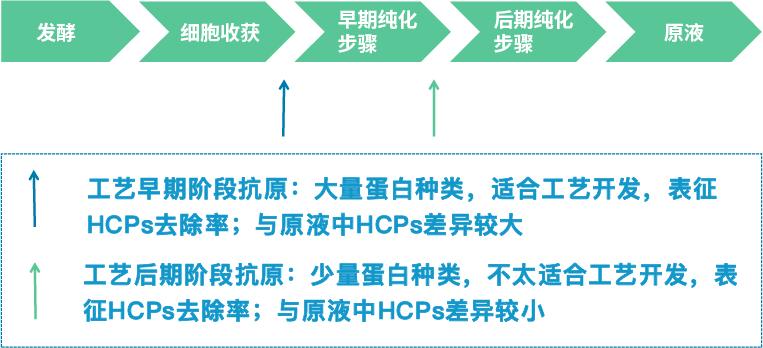
图1 HCPs校准品的选择
按照美国药典1132章节的要求,HCPs校准品需满足代表性要求,即能覆盖实际工艺产品生产中的HCPs[1]。从HCPs免疫检测方法使用目的和预期风险管理要求考虑,满足工艺开发和验证,同时为了应对下游工艺中潜在的异常工艺失效,或工艺变更需求(图2),建议采用上游发酵工艺末端,如澄清处理后工艺点的样本作为HCPs的来源[2]。
在实际制备中,可采用空细胞或空载细胞在模拟实际工艺的预定条件进行采集,通过二维电泳或高分辨率质谱等蛋白质组学方法进行模拟工艺和实际工艺下HCPs的代表性表征分析。越靠近下游HCPs蛋白种类越少,也越接近DS中HCPs,但是其可能无法满足工艺开发和验证需求,也无法保证工艺的潜在风险,往往不推荐使用,或仅作为上游工艺HCPs免疫检测法的辅助使用。
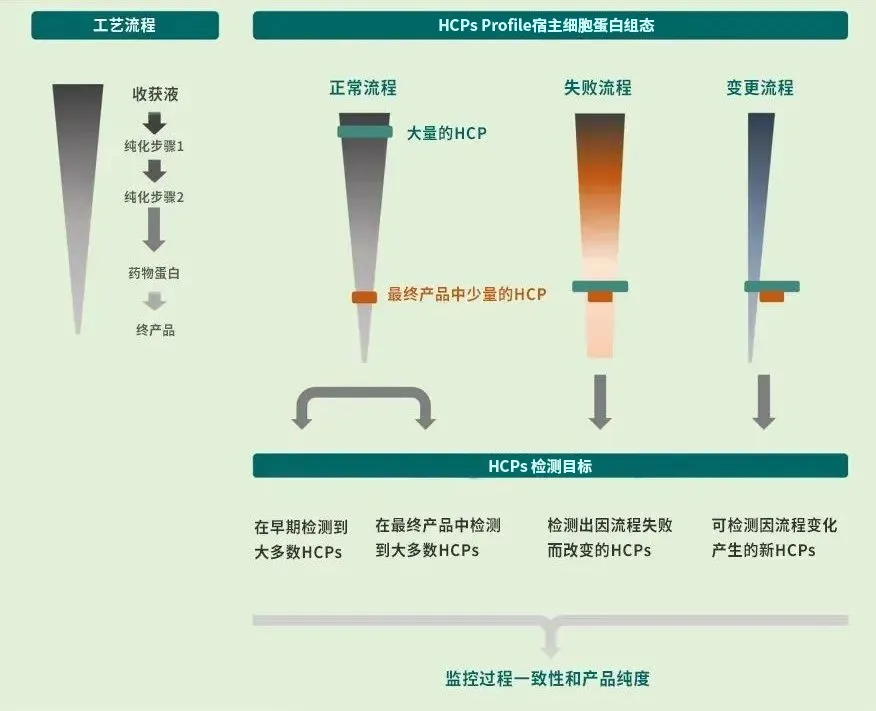
图2 HCPs检测监控目标[2]
赋值方法及溯源:
除了上述HCPs来源不同,即标准品的HCPs谱的差异,导致试剂盒检测结果差异之外,HCPs校准品的赋值方法和溯源的统一也是不同试剂盒存在差异的主要原因之一。
目前对于HCPs校准品的赋值和溯源方面没有统一的规定。美国药典1132章节中规定可以采用总蛋白检测的法规方法进行赋值,如BCA法、Bradford法、lowry法和紫外-可见分光光分度法等。由于HCPs来源中往往同时存在核酸,胞膜脂类,培养基中的氨基酸等非HCPs成分会干扰总蛋白的检测准确性,需要在检测之前进行纯化前处理,同时对总蛋白检测方法进行方法学确认。
HCPs是一种多蛋白质的混合物,总蛋白定量方法之间检测结果会存在一定程度的差异,这也是导致HCPs免疫检测方法结果差异的原因之一。若HCPs蛋白定量方法间检测结果差异较大,一般同时采用2种以上经过确认的方法检测,最后取均值。
总蛋白检测方法的定量限一般只能达到μg/mL水平,但是HCPs检测试剂盒的产品校准品在ng/mL水平。从HCPs高浓度原液稀释到低浓度产品校准品中存在稀释误差,需要对产品校准品进行重新标定赋值。目前在国内可参考中检院李加等老师发表的文章“首批Vero细胞蛋白质标准品的研制”来建立量值溯源体系[3],该课题获得国家药典委疫苗制品专家委员会确认通过。
图3举例湖州申科HCPs ELISA试剂盒产品,按照文章的要求建立的溯源路径,制备二级校准品,高浓度的一级校准品通过总蛋白检测方法溯源至国标牛血白蛋白,试剂盒内的产品校准品通过一级校准品和湖州申科大肠杆菌ELISA检测体系进行赋值,保证结果的稳定性。
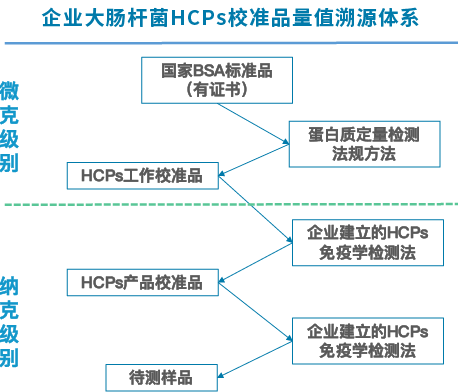
图3 湖州申科大肠杆菌HCPs校准品量值溯源
HCP抗体的质量评估
HCPs抗体覆盖率的影响:
抗体是良好免疫检测方法的另一重要因素,由于HCPs的多蛋白混合物的特性,对HCPs抗体除了基本的特异性和亲和力要求外,还需要评价HCPs抗体能够识别HCPs蛋白种类的能力,即覆盖率(Coverage Rate)评价。
抗体覆盖率低,对样本中HCPs的识别越少,导致不同试剂盒的检测结果差异,会造成漏检风险,可能影响后续临床试验的顺利进行。
抗体纯化方式的影响:
对于HCPs抗体的纯化方法,目前美国药典1132章节推荐有两种方式,包括proteinA或proteinG亲和柱层析法和HCPs抗原亲和柱层析法。两种方法各有优缺点,均符合监管的要求。
表1 HCPs抗体纯化方法[2]
| Type of Purification | Pros | Cons |
| Protein A or G Affinity Column Chromatography | Robust and reproducible for quickly separating IgG fraction from other serum proteins | Lower proportion of antibodies specific to HCPs and may have a higher amount of low affinity antibodies |
| HCP Affinity Colum Chromatography | Enriches for specific high affinity anti-HCP antibodies;excludes nonspecific antibodies and serum proteins | More skill and documentation required to make and maintain resins consistently. Some high affinity anti-HCP antibodies may not be eluted in usable form and may not be recovered |
在实际使用过程中,这对不同产品可能会导致检测结果的差异。两者方法得到的抗体主要区别是HCPs抗体有效含量的占比。HCPs抗原亲和柱层析法显然占比高,但是也存在某些HCPs抗体丢失的情况,这也会导致针对某些样本的检测结果比前者偏低,需要企业在实际方法建立时进行充分的评估。
HCPs抗原亲和柱层析法对纯化工艺要求更高,为保证抗体批间一致性,需要重点考察HCPs抗原柱制备工艺,柱子的使用寿命,再制备的一致性等问题。
板式的酶联免疫吸附法是将有限的HCPs抗体包被在96微孔板上作为捕获抗体,因此proteinA或proteinG亲和纯化抗体的实际有效HCPs包被抗体量会十分有限,跟HCPs抗原亲和纯化相比,可能存在对较高浓度HCPs校准品识别是不充分的,导致校准曲线的差异。
同时,对HCPs含量丰富的中间品的检测往往存在偏低的现象,虽然可以得到样本线性稀释度范围,但是如图4情况所示,在相同或相近稀释度下,proteinG纯化抗体由于有效抗体含量少,对某些HCPs的抗体量不足,实际HCPs识别的程度是有区别的,导致样本检测信号差异,最终导致检测值的差异。各家企业制备的抗血清的质量应该是首要关键点,高效价和高覆盖率,高含量HCPs的抗体下采用proteinG方式在某些情况下也可以满足要求。
图4 HCPs免疫检测中抗原过量模型[4]
总 结
HCPs免疫学检测方法间的差异来源于HCPs校准品,HCPs抗体等关键组分的制备和表征。这些关键组分本身的变异度比较大,导致各家试剂盒的检测结果的差异较大。
因此,在使用该试剂盒之前,需要结合企业自身的产品进行对比分析,选择最合适的试剂盒。
参考文献:
[1] USP <1132> Residual Host Cell Protein Measurement in Biopharmaceuticals.
[2] Pilely K , Johansen M R , Lund R R , et al. Monitoring process-related impurities in biologics–host cell protein analysis[J]. Analytical and Bioanalytical Chemistry, 2022, 414(2):747-758.
[3] 李加, 石磊泰, 王玲,等. 首批Vero细胞蛋白质标准品的研制[J]. 中国生物制品学杂志, 2020, 33(9):6.
[4] Zhu-Shimoni J , Yu C , Nishihara J , et al. Host Cell Protein Testing by ELISAs and the Use of Orthogonal Methods.