产品中心
ELSIA法作为目前监测宿主细胞蛋白残留最常用的方法,其优势在于高灵敏度和特异性,低成本以及操作简单,可满足多种生物制品检测的需求。
然而,ELSIA方法却存在天然的缺陷:
① 并不是所有的HCP都可以与抗体产生免疫反应,存在漏检风险;
② 抗体组成种类和数量与HCP不匹配而出现的检测结果不稳定。
因此,基于HCPs组成的多样性和复杂性,无论是采用商业化或定制化HCP ELISA检测试剂盒,都需要对试剂盒相关的抗体进行HCP抗体覆盖率研究,保证ELISA试剂盒中使用的抗体可充分覆盖工艺流程中的HCPs,尤其是一些高风险以及低丰度的HCPs。
为了更好地控制工艺和产品质量的稳定,各国监管机构均要求提供使用的HCP ELISA试剂盒的抗体覆盖率数据。一般需进行覆盖率分析的场景一般有以下几种情况:
• 临床II期后,若是继续使用商品化试剂盒,则需要评估试剂盒抗体覆盖率是否可以继续用于质量监控;
• 临床III期及以后阶段,产品研究者开发了平台化或工艺专属型的HCP监测方法,该类试剂盒在使用前要评估覆盖率水平与商业化覆盖水平的差异;
• 申报时没有提交覆盖率数据,监管机构可能会对企业提出发补的要求;
• 产品上市后发生了包括生产场地变更,工艺变更,HCP分析方法变更等因素的变更,研究者则需要评估变更前后抗体覆盖率水平的差异,以及该差异对药品质量与安全带来的影响[1]。
一般推荐在临床II期末进行抗体覆盖率表征,此时一般生产工艺已经固定并且有相对充足的研究时间[2,3]。
传统方法vs创新技术大对比
关于抗体覆盖率评估法规中一般推荐的方法有两大类:一类是传统2D-WB法,另一类是基于抗体亲和的免疫捕获类方法。
传统2D-WB法存在需要蛋白变性,样品经过前处理会破坏蛋白天然表位;转膜效率低;易产生非特异性,难以代表真实的覆盖率水平等方法缺陷。
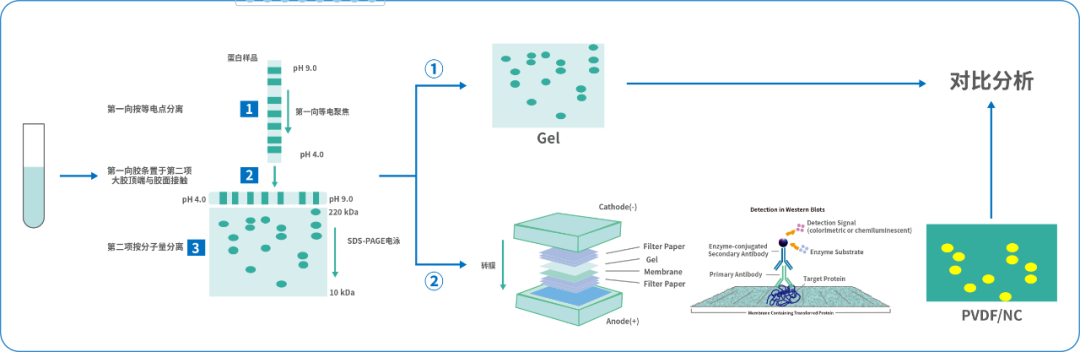
图1 2D-WB进行抗体覆盖率验证的流程
湖州申科自主开发了免疫磁珠捕获分离技术[4](immunomagnetic beads separation,IMBS),利用免疫磁珠的半液态性质,可以在悬浮的条件下与HCP样本充分混匀结合,整个过程蛋白无需变性,结合方式与ELISA检测条件相似,可以获得更真实的覆盖率结果。
IMBS整体的技术流程如图2所示,首先将HCP多克隆抗体偶联到磁珠上,偶联抗体的磁珠与样品HCP共孵育,洗涤未结合的HCP,洗脱收集磁珠上偶联抗体结合的HCP,将未经免疫磁珠的处理HCP样品与经IMBS亲和吸附获得的HCP分别用2D或MS进行抗体覆盖率分析。
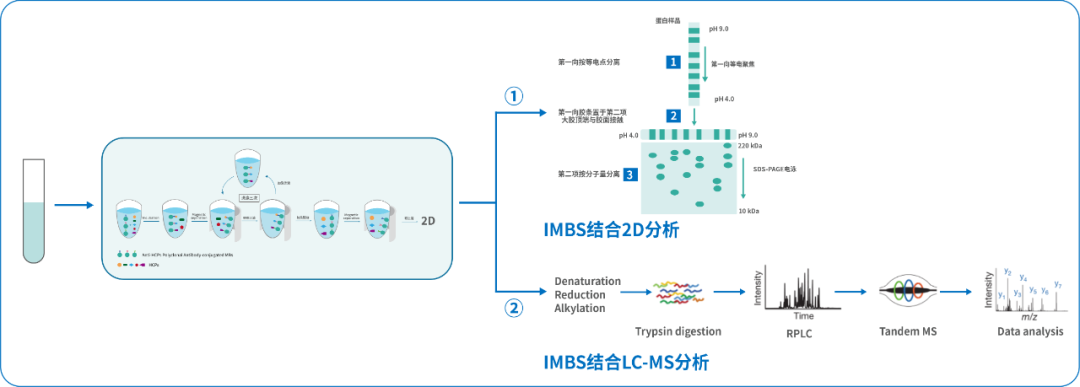
图2 IMBS进行覆盖率评估技术流程图
HCP抗体覆盖率评估实验操作复杂,需要在建立实验方法阶段对关键步骤进行充分的验证,以证明实验方法的稳健性。湖州申科开发的基于磁珠捕获的IMBS方法,在开发过程中对关键步骤进行了充分验证,相关结果经过专业评审,验证的内容如下(部分):
• 方法优化:针对磁珠与抗体的偶联比例、洗涤液体积、洗涤次数、洗脱次数等关键参数进行优化验证,以保证方法的稳健性;
• 过程质控:二维电泳存在实验步骤多,时间跨度长,中间步骤难以控制等缺陷,因此在等电聚焦实验部分设计了荧光标记多肽,可快速判断等电聚焦效果。在SDS-PAGE电泳的两侧增加40ng银染质控,用于胶后期的银染显色的控制;
• 方法重复性:针对2D分析以及LC-MS分析我们都进行了重复性确认,其中2D分析方法重复性可达到80%以上,LC-MS分析方法可到90%以上。
• 上样量优化:针对2D分析以及LC-MS分析我们进行了上样量确认,消除上样量差异对检测结果带来的影响;
• 假阳性:排除样品与阴性抗体之间是否存在非特异性结合,确定IMBS实验所设定的步骤、参数是否有假阳性结果存在。
*以上验证内容原文已发表于《中国新药杂志》[5]。
IMBS®技术平台案例展示
我们使用两种方法对CHO多克隆抗体进行了抗体覆盖率分析。如图3A图所示,IMBS-LC-MS法可以检测到2400多个蛋白,验证CHO-HCP抗体覆盖率为86.8%;我们使用IMBS-2D方法进行抗体覆盖率分析,图3B图所示,可以检测到1100多个蛋白点数,覆盖率结果在71.0%。

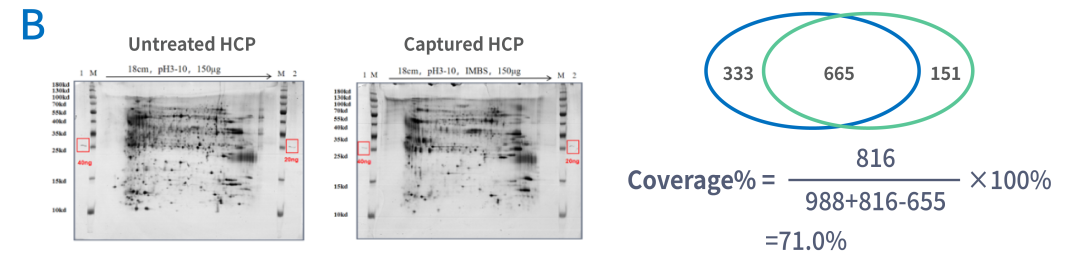
图3 分别使用IMBS-LC-MS(A图)和IMBS-2D方法(B图)对CHO多克隆抗体进行了抗体覆盖率分析
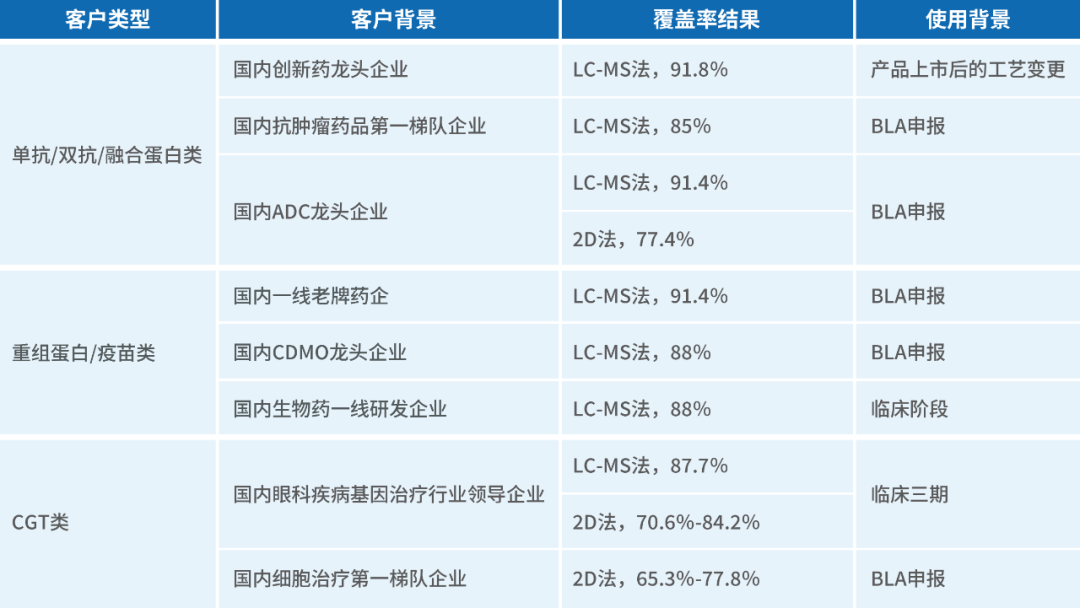
2023-2024年近一年时间内,湖州申科通过合规的质量体系,验证的覆盖率分析平台,已承接抗体覆盖率服务50+案例,助力各类生物制品申报,具体内容如下表所示:
参考文献
[1] 邱晓,项金忠,赵靖,等.《已上市生物制品药学变更研究技术指导原则(试行)》解读[J].中国食品药品监管, 2023(2):28-35.
[2] Wang X , Hunter A K , Mozier N M .Host cell proteins in biologics development: Identification, quantitation and risk assessment[J].Biotechnology and Bioengineering, 2009.
[3] 国家药典委员会. 生物样本定量分析方法验证指导原则. 《中华人民共和国药典》2020年版 四部 通则 9012. 北京: 中国医药科技出版社, 2020.
[4] USP. (2022). <<1132> Residual Host Cell Protein Measurement in Biopharmaceuticals >. United States Pharmacopeia. 第45版. Rockville, MD: United States Pharmacopeial Convention.
[5] 豆敏华,陈秋燕,张宏声等,磁珠免疫捕获技术IMBS运用于宿主细胞蛋白抗体覆盖率分析,中国新药杂志(2024)