产品中心
全球畅销且快速增长的抗体、蛋白类药物等生物药由相应工程细胞生产。生物制品药物生产过程中的宿主内源性蛋白,被称为宿主细胞蛋白(host cell proteins, HCPs)会随着不同工艺流程而部分残留在药物中。
• 残留的HCPs作为外源蛋白可能会在不同程度上引发机体的免疫应答,导致过敏反应或其它不良反应。
• 另外还有一些残留HCPs具有蛋白酶或脂酶的活性,可能导致蛋白药物或辅料的降解,进而增加药物产品的质量和疗效的不稳定性。
基于此,对药物中HCPs的定性与定量检测就显得尤为重要。全球各国药典如美国药典,欧洲药典以及中国药典等都对HCPs检测提出了具体要求和标准。
ELISA方法:
在HCPs的分析方法中,ELISA方法是广泛应用的,并作为QC日常放行检测的主要手段。ELISA方法相对简单、精度良好,方便设定控制范围和建立技术规范,适用于产品开发和过程控制;但ELISA方法检测依靠抗原抗体特异性结合,因此用存在于生物制品中的HCPs作为免疫原生产出的抗体质量至关重要。
无论是商品化ELISA试剂盒,还是自制的多克隆抗体,如果抗体的特异性和适用性不够高,都有可能带来HCPs漏检的风险,从而对生物制品质量安全带来风险。除此之外,ELISA检测HCPs使用多克隆抗体,无法针对性的提供高风险HCPs残留蛋白真实存在情况。
LC-MS方法:
高分辨液相质谱(LC-MS)采用母离子的精确质量和碎片离子的信息来确定肽段序列,并通过蛋白质序列数据库比对确定HCPs具体信息,可以精准分析单个HCP的存在情况,特别是对高风险蛋白的精准分析就非常重要。
USP <1132.1>
2023年5月1日,USP在最新一期的药典论坛PF49(3)中发布了通则<1132.1> Residual Host Cell Protein Measurement in Biopharmaceuticals by Mass Spectrometry(质谱法测定生物药中残留宿主细胞蛋白)。
作为最新的HCPs检测相关技术通则,通则<1132.1>主要介绍了LC-MS技术在HCPs检测中的应用,从样品制备、质谱测试条件的建立、数据的分析、质谱方法验证等多个方面,详细阐述了质谱技术在HCPs中应用的优势与注意事项。
作为一种先进的分析技术平台,质谱技术在HCPs分析中的应用,以及与ELISA方法和其他分析方法结合使用,有助于生产企业在产品的整个生命周期中更好地理解和建立HCPs的检测和清除,保证产品质量的稳定。
虽然,<1132.1>介绍了LC-MS技术在HCPs检测中的优势,但作为生物制品HCPs检测的新趋势,仍需要考虑以下几点:
• 稳定性:需要HCPs LC-MS检测流程进行验证,全流程都需要有严格的QC控制,确保检测结果的一致性和稳定性。
• 可重复性:不同类型生物制品中HCPs提取效率不同,不同人员操作存在差异,需要在上机前通过不同方法评估HCPs的提取效率,避免人为因素造成结果重复性差。
• 准确度:方法开发与验证阶段,如何设立内标与定量算法,通过内标响应回算得到HCPs的含量,确保定量结果的准确性。
• 抗干扰能力:高丰度蛋白和特殊基质会对质谱检测产生影响,需要通过前处理手段对高丰度蛋白或特殊的基质进行去除,以减少其对HCPs肽段在质谱检测时的影响。
• 真实性:样品中除HCPs以外的物质在质谱分析中同样会产生质谱信号,如何去除复杂的背景噪音避免假阳性和假阴性的出现,需要建立合理标准的生信分析流程。分析流程建立过程中同样需要建立严格的质控QC标准,并通过后期不同方法进行验证,确定其标准的真实性。
--
湖州申科参考通则<1132.1>阐述的内容,同时凭借深耕生物制品质量控制领域10多年的经验,针对LC-MS检测HCPs方法进行了评价与优化。同时通过对LC-MS检测HCPs整体流程建立完整的质控,建立起一套抗干扰能力强、稳定性好、准确度高、结果真实可靠的LC-MS检测HCPs标准方法。
据此,HZSKBio® LC-MS HCPs检测技术平台分成样品制备、质谱检测、数据生信分析及质谱结果方法验证四部分进行质控体系的建立(见图1)。
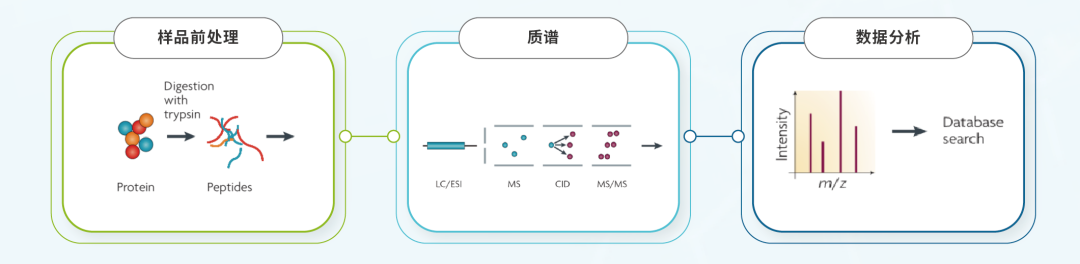
图1 LC-MS HCPs检测流程[1]
01 样品制备
针对不同生物制品生产所用的宿主多样性,湖州申科开发了对应合适的前处理流程,包括特殊基质样品和高丰度蛋白样品中的HCPs富集提取。同时自主开发蛋白提取,酶切后的定量节点和内标,对样品的提取回收率进行质控,保证前处理流程稳定性,实现前处理的全流程质控和方法验证。
HZSKBio® IMBS™抗体亲和平台,可特异性高效结合不同工艺流程样品中残留的HCPs,结合HZSKBio® LC-MS平台,可实现对不同工艺阶段的样品抗体覆盖率的准确评价。目前已经使用HZSKBio® IMBS™ & LC-MS平台完成293T、不同工艺E.coli、CHO、Vero、MDCK、Sf9等不同工程细胞HCPs抗体覆盖率的检测分析。
02 蛋白质谱
湖州申科开发了一套适应QC实验体系,包括单蛋白酶解样品、复杂体系酶解样品等的质控标准品;对液相保留时间,仪器响应做相应的性能评价,控制仪器带来的结果偏差;以及在不同批次进样中间,掺入QC样品,监控进样前、或进样过程中液相质谱稳定性。
03 生信分析
湖州申科专业的生信团队对质谱数据进行生信分析,同样建立了完整的QC体系;结合蛋白数据库与HZSKBio® LC-MS平台完成293T、不同工艺E.coli 、CHO、Vero、MDCK、Sf9等不同工程细胞在不同工艺阶段所出现的HCPs表征数据,建立不同宿主不同工艺阶段的蛋白数据库,用于质谱后的生信库比对;还建立了CHO等细胞的高风险蛋白数据库。
湖州申科建立了上述工程细胞质谱一级与二级质谱图库。针对高风险的HCP,建立靶向的蛋白数据库,根据不同采集模式的特点与优势,开发基于DDA和DIA采集模式的非靶向蛋白定量方法,以及PRM的靶向蛋白定量方法。由于数据分析依赖于DDA的谱图库,而DIA数据采集模式获得的数据稳定性更高,重现性更好,湖州申科建立了自有的蛋白质组数据库,采用DIA定量流程,保证质谱方法的稳定性和重现性,满足GMP要求。
04 质谱结果验证
湖州申科对质谱的结果验证分方法学验证和多平台验证,方法学验证主要包括检测下限、准确度、精密度、特异性。
• 检测下限:
通过蛋白质组学数据分析软件对结果进行定性分析,将能够鉴定到的含量最低的内标的量作为本方法的检测下限。
• 准确度:
LC-MS方法开发阶段,通过加入内标,对定量分析方法进行定量准确度的验证,准确度的范围要求在100±20%以内。
• 精密度:
精密度描述为本定量方法重复测定的接近程度,通过内标对精密度进行验证,定义为测量值的相对标准差(变异系数),变异系数CV<15%。
• 特异性:由于检测的样品中加入了其他来源的蛋白,这些蛋白中也可能存在HCP蛋白,可能会对检测产生干扰,通过考察检测到的肽段的特异性,保证数据结果可靠。同时也作为选择内标蛋白的标准之一。
05 多平台验证
湖州申科与通则<1132.1>中提到的与ELISA方法和其他分析方法(West Blotting)结合使用,对检测的结果进行多方验证。公司自主研发的HCPs系列ELISA检测试剂盒包括CHO、293T、不同工艺E.coli、Vero、MDCK、Sf9等宿主工程细胞为LC-MS结果准确与真实性验证提供了强力的支持,也为助力生产企业在产品的整个生命周期中更好地检测HCP的清除过程提供支持。
综上所述,HZSKBio®高分辨质谱平台依照通则<1132.1>提到的LC-MS相关信息建立的特色归纳如下:
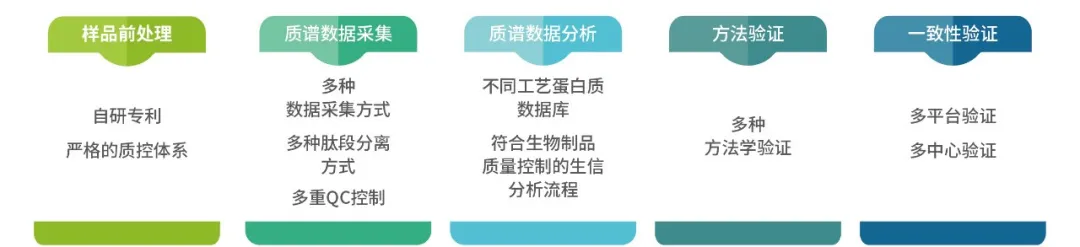
图2 HZSKBio®LC-MS HCPs检测流程
湖州申科推出了基于高分辨质谱的HCPs鉴定和定量分析定制化服务:
服务项目 | 内容 | 备注 |
HCP蛋白检测定制化服务 | 常规生物制品HCP检测 | ELISA、2D、LC- MS/MS |
定制化HCP蛋白数据库(含高危、工艺相关蛋白) | ||
不常见生物制品HCP检测 | ||
抗体覆盖率服务 | ELISA HCPs(常见工程细胞)抗体覆盖率测试 | IMBS相结合 |
ELISA HCPs(常见工程细胞)参考品表征 | ||
靶向HCP检测 | 高风险HCP蛋白靶向检测方法建立 | |
蛋白种属鉴定 | LC-MS法测定不同来源样品物种特异性肽段 |
参考文献:
[1] Vanderlaan M, Sandoval W, Liu P, Nishihara J., Tsui G, Lin M, Gunawan F, Parker S, Wong RM, Low J, Wang X, Yang J, Veeravalli K, McKay P, Yu C, O’Connell LO, Tran B, Vij R, Fong C, Francissen K, Zhu-Shimoni J, Quarmby V, Krawitz D. Hamster Phospholipase B-Like 2 (PLBL2), a host cell protein impurity in CHO-derived therapeutic monoclonal antibodies. BioProcess International2015; 12(4): 18-29.