产品中心
宿主细胞蛋白(HCPs)是生物制品生产过程中产生的关键工艺相关杂质之一,可导致患者不良的免疫反应、超敏反应,另外也存在导致产品蛋白的降解等问题,影响产品的安全性和有效性,是一项关键质控指标。
HCPs检测方法
HCPs残留检测应用最为广泛的方法是ELISA法,操作简单、灵敏度高,通量较高,是HCPs残留检测的日常放行检方法,各国药典规定了用酶联免疫法进行HCPs残留检测。
然而,ELISA 方法检测HCP残留仍面临诸多挑战。在实际的工艺生产过程中,宿主来源、生产工艺、纯化方式、生产规模等因素均可能对HCPs的种类及复杂性产生影响。如使用商业化的通用型HCP ELISA试剂盒检测产品中的HCPs,容易出现因其抗体特异性和适用性不高导致的漏检,对生物制品质量安全带来风险;此外,商业化的HCP ELISA试剂盒换批时还需再次验证。基于此,USP、EP针对HCPs检测均建议在Ⅲ期临床阶段前采用工艺或平台相关HCP ELISA检测试剂盒,并要求对HCP抗体开展覆盖率验证。
E.coli作为经典的原核工程细胞,在重组蛋白类生物制品生产中发挥重要作用。随着细胞和基因治疗产业的崛起,高质量的质粒生产需求巨大,E.coli宿主细胞应用范围愈加广泛。然而,实验研究发现,利用克隆菌株碱液裂解工艺开发的HCP检测试剂盒与传统的通用型检测试剂盒的检测结果存在较大的差异。
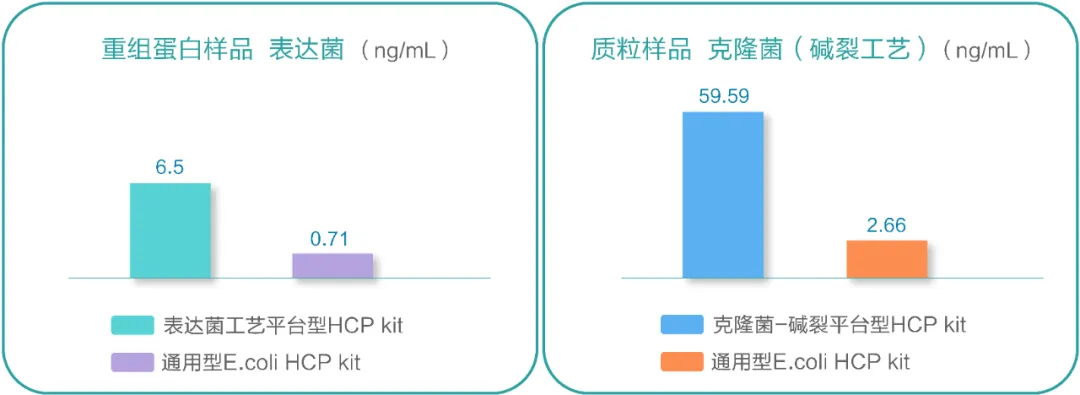
图1 不同E.coli菌株和工艺表达产品检测结果
这是因为在碱裂过程中,HCPs表位发生了巨大变化,与通用的E.coli HCP ELISA试剂盒中所用HCPs抗原和参考品相比差异大,具体表现为通用型试剂盒中抗体检测能力弱,导致HCPs检测值偏低,对质粒载体质量控制产生了极大挑战。
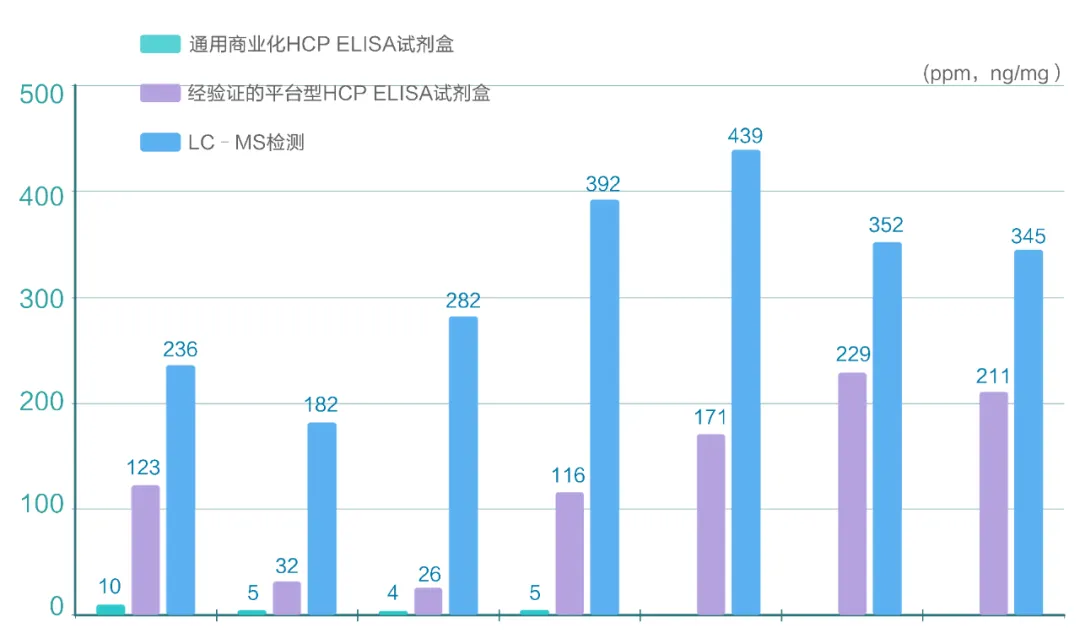
图2 商业化、经验证的试剂盒与LC-MS检测结果
需要特别注意的是,单克隆抗体药物生产过程中,可通过Protein A高效地去除HCPs残留;但是基因治疗药物,如AAV、溶瘤病毒等的生产中并没有如此工艺来去除HCPs,因此尤其是针对CGT制品,更需要综合来分析检测HCPs残留,需要建立平台型和工艺特异型的HCP检测方法。
随着蛋白组学技术的发展,2D电泳、LC-MS等方法用于辅助分析生物制品中HCPs的组成,能更客观、更全面地验证HCP ELISA试剂盒检测特异性和实际HCP覆盖率2D-SDS-PAGE,与ELISA相对的正交方法,可用于HCP的表征分析。
LC-MS/MS是一种可靠的蛋白质组分析技术,具有分辨率高、准确度高的特点,可用于定性检测低含量HCP,且能通过建立谱库鉴定HCP的种类,其挑战是如何使LC-MS方法检测HCPs满足GMP对放行检的要求。在MS检测中,可以通过加入表征清楚的内标和外标蛋白,准确地分析HCPs的组成并鉴别其中高风险蛋白,更有效地帮助开发产品相关的HCP ELISA检测方法,推进工艺优化,促进产品获批上市进程。
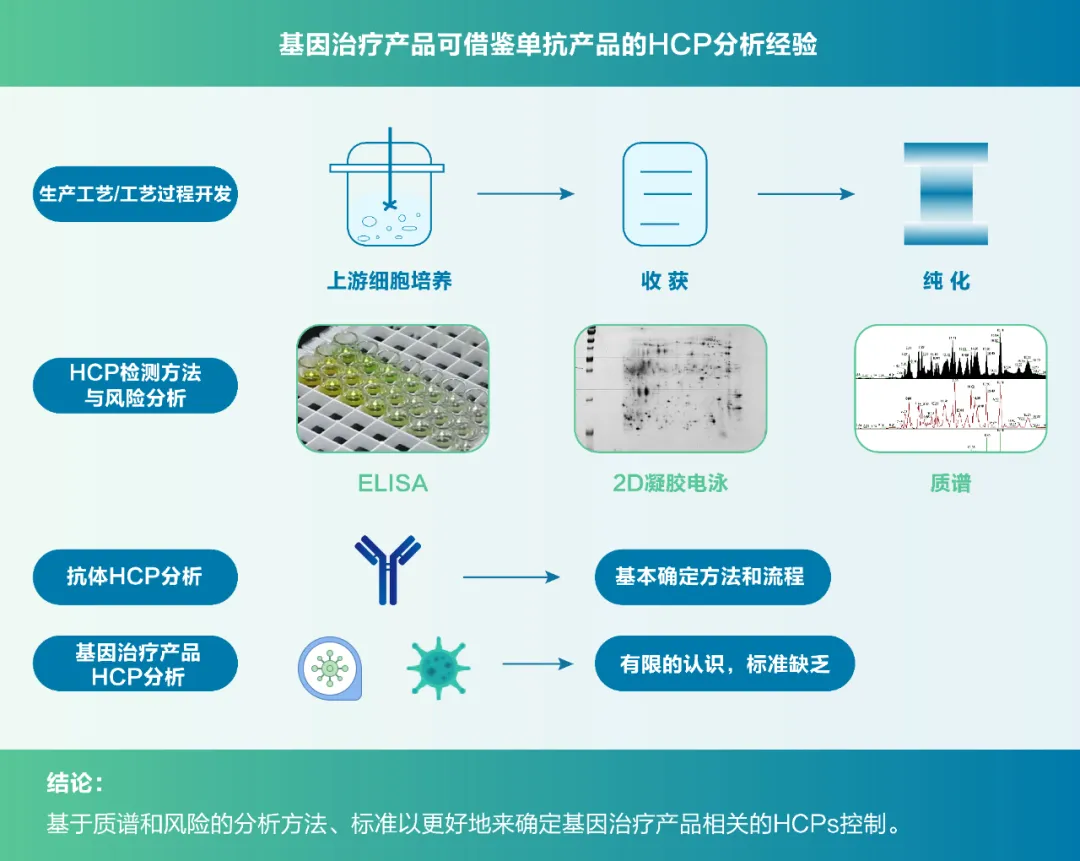
HCPs检测全面分析策略
鉴于上述风险及法规要求,综合HCPs残留检测方法存在问题与现状,建议在进行全面的HCPs检测分析时,应考虑以下几点:
• 产品开发前期如使用商业化HCP ELISA试剂盒,必须经过适用性验证,包括特异性和抗体覆盖率的分析验证;抗体覆盖率可采用二维电泳和质谱方法进行正交分析验证。
• 尽早布局工艺或平台型HCP ELISA试剂盒,以加快产品开发进程,保证产品质量,加速产品获批上市。
• 开发工艺或平台型HCP ELISA试剂盒时,因不同细胞系/菌株蛋白表达和分泌差异大,应采用不同的方法组合来检测HCPs,以使检测结果更加准确和全面;此外,可通过多种免疫方式来制备HCP抗体,以加强抗体捕获和富集HCPs的能力,提高试剂盒检测性能。
• 辅助采用2D、MS等蛋白组学技术分析实际工艺样品中的HCPs残留和组成,特别是其中特定的可能存在的高风险HCPs,可有效提高检测结果准确性,保障产品质量安全。
SHENTEK®E.coli HCP检测试剂盒
据统计,已批准上市的三分之一的重组蛋白药物由大肠埃希菌生产表达,其中大肠杆菌BL21是生产重组蛋白最常用的菌株。大肠杆菌K-12菌株所衍生出的DH5α、Top10、JM109等菌株广泛使用于基因克隆和质粒的生产;与使用大肠杆菌表达生产重组蛋白的工艺不同的是,质粒的提取纯化生产常用碱裂工艺。
为满足上述工艺要求,湖州申科自主研发生产了三种E.coli HCP检测试剂盒(酶联免疫吸附法)。
☑️ E.coli表达菌HCP残留检测试剂盒(一步酶联免疫吸附法)
适用于BL21菌株表达蛋白工艺中的中间品、原液及终产品等的HCP定量检测
☑️ E.coli克隆菌碱裂HCP残留检测试剂盒(酶联免疫吸附法)
适用于碱裂法提取质粒工艺的中间品、原液及终产品等的HCP定量检测
| 性能指标 | 技术参数 |
| 线性范围 | 1 ng/mL-243 ng/mL,相关系数R²>0.9990 |
| 准确性 | 回收率 80%-120% |
| 定量限 | 低于1 ng/mL |
| 特异性 | 与CHO、HEK293、Vero和酵母宿主蛋白无交叉反应 |
| 重复性 | CV<15% |
| 适用性 | 实验验证多种样本基质,且样品稀释后的HCP呈线性 |
| 稳定性 | 批内与批间一致性高,结果稳定 |
| 覆盖率 | 风险因子:校准品与HCP 抗体均能覆盖E.coli HCP常见高风险因子 方法验证:采用IMBS-2D和IMBS- MS两种方法正交检测抗体覆盖率 |
HCPs检测技术服务
‣ IMBS SHENTEK™抗体覆盖率验证平台
ELISA HCP检测高度依赖于试剂盒中HCP抗体对于总宿主细胞蛋白的匹配度。如抗体覆盖率不足,可能导致某些残留的HCPs漏检。湖州申科提供基于免疫磁珠亲和分离的IMBS-2D和IMBS-MS等两种方法来评估抗体覆盖率,并采用自主研发的质控保证实验的有效性。
‣ MacSHENTEK™检测平台
拥有Thermo Scientific™ Q Exactive™ Plus 和 Q Exactive™ HF 混合四极杆-Orbitrap™ 质谱仪,能够实现广泛的定性和定量应用,专注用于生物制品中HCPs残留鉴定、HCPs抗体覆盖率分析等。
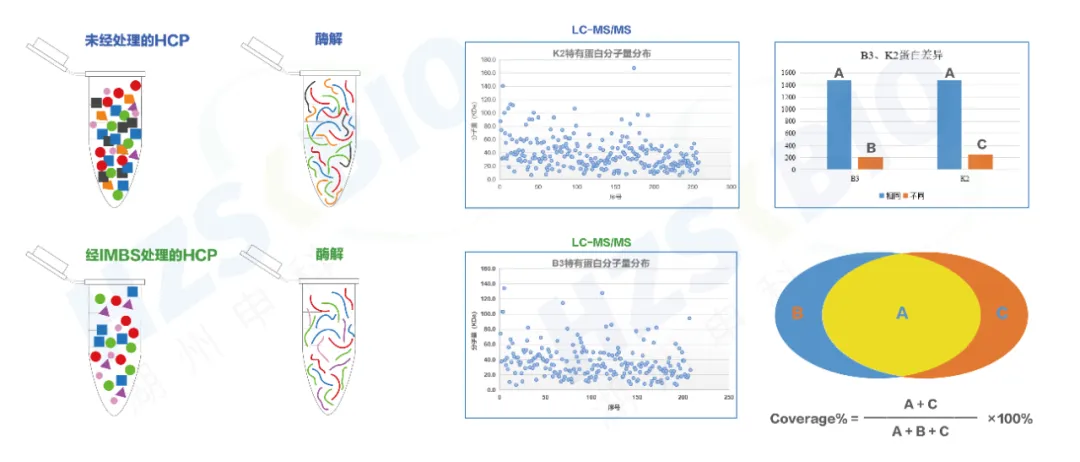
图3 LC-MS实验流程(覆盖率验证)