产品中心
在全球医药监管日益严格的背景下,欧洲药典(EP)对抗生素的热原检测要求不断更新。许多品种的方法已从传统的家兔热原检测法(RPT,Rabbit Pyrogen Test)转变为细菌内毒素检测法(BET,Bacterial Endotoxin Test)。然而,仅使用BET法可能不足以完全控制热原风险,非内毒素热原(NEP)的“隐形威胁”是当前合规申报的核心挑战,这也是单核细胞活化试验(MAT)法被推上风口的关键原因之一。
法规倒计时:RPT 正式退场,MAT 登上舞台
• 2025.07.01起,EP 11.8补编版正式删除家兔热原法(RPT),MAT 成为唯一被推荐的替代方法[1];
• 2025年8月,EP 12.0版本发布,进一步强化指导原则:
○ EP 5.1.13(致热原性) 明确规定:若选择BET作为唯一检测方法,必须提供排除产品中存在NEP的详细风险评估报告。
○ EP 2.6.30 正式将单核细胞活化试验(MAT) 列为能够检测所有类型热原(包括内毒素与各类NEP)的法定方法。
• 2026年起,欧洲药品质量管理局(EDQM)在现场核查中,已将“是否建立并执行了有效的NEP控制策略”列为高频检查项目。
这意味着,对于抗生素出海企业而言,NEP已从一个技术概念,升级为一项紧迫的合规必答题。
抗生素中热原控制发展历史概述
EP第三版(1997年版)抗生素热原检测主要以RPT为主,自1986年《欧洲动物保护公约》通过以来,欧洲药典委员会加速开展体外替代方法的应用,以便响应3R原则(减少、优化、替代动物试验)的推进。
抗生素热原检测RPT转变为BET列表[2]
发酵产品 | 从发酵产品衍生的半合成产品 | |
Amphotericin B | Amoxicillin Na | Netilmicin sulphate |
随着时间推移,EP7.0版49种发酵或半合成半发酵抗生素专论中热原检测RPT被BET取代。然而,这场替代浪潮并未覆盖所有抗生素,EP11.0版仍有部分抗生素保留了RPT[3],其主要原因在于,已有数据不足证明RPT可以被BET替代。
抗生素热原检测RPT未转变为BET列表
类别 | 具体抗生素品种 |
半合成产物 | Amikacin、Chloramphenicol sodium succinate、Colistimethate sodium、Dicloxacillin sodium、Flucloxacillin sodium |
发酵产物 | Kanamycin acid sulfate、Kanamycin monosulfate)、Polymyxin B sulfate |
EP已正式废除RPT,并明确将MAT作为首选替代方法。那么未完成RPT替换的品种该如何锚定适配的热原检测方法?已完成BET替代的49种抗生素,是否就真正实现了热原防控的 “高枕无忧”?
EP5.1.13致热原性 一般性章节中给出答案:
• 只有在排除非内毒素热原性物质存在的情况下,BET法才适用;
• 如果选择BET作为检测特定产品致热原性的唯一方法,则必须对潜在的NEP进行风险评估;
• 若无法排除NEP的存在,则应使用MAT;
• 对于已获批工艺,建议评估其潜在的NEP风险。一旦生产工艺发生变更,也须开展NEP风险评估,并将报告随变更申请一并提交。
抗生素申报合规风险——NEP恰好是“高发区”
抗生素生产的复杂工艺本身,就是NEP的潜在引入点。从上游发酵的原材料与代谢产物,到下游纯化与设备清洁的每个关键步骤,均需进行前瞻性的风险评估。只有对全过程进行系统审视,才能构建起针对NEP的全面防控体系。
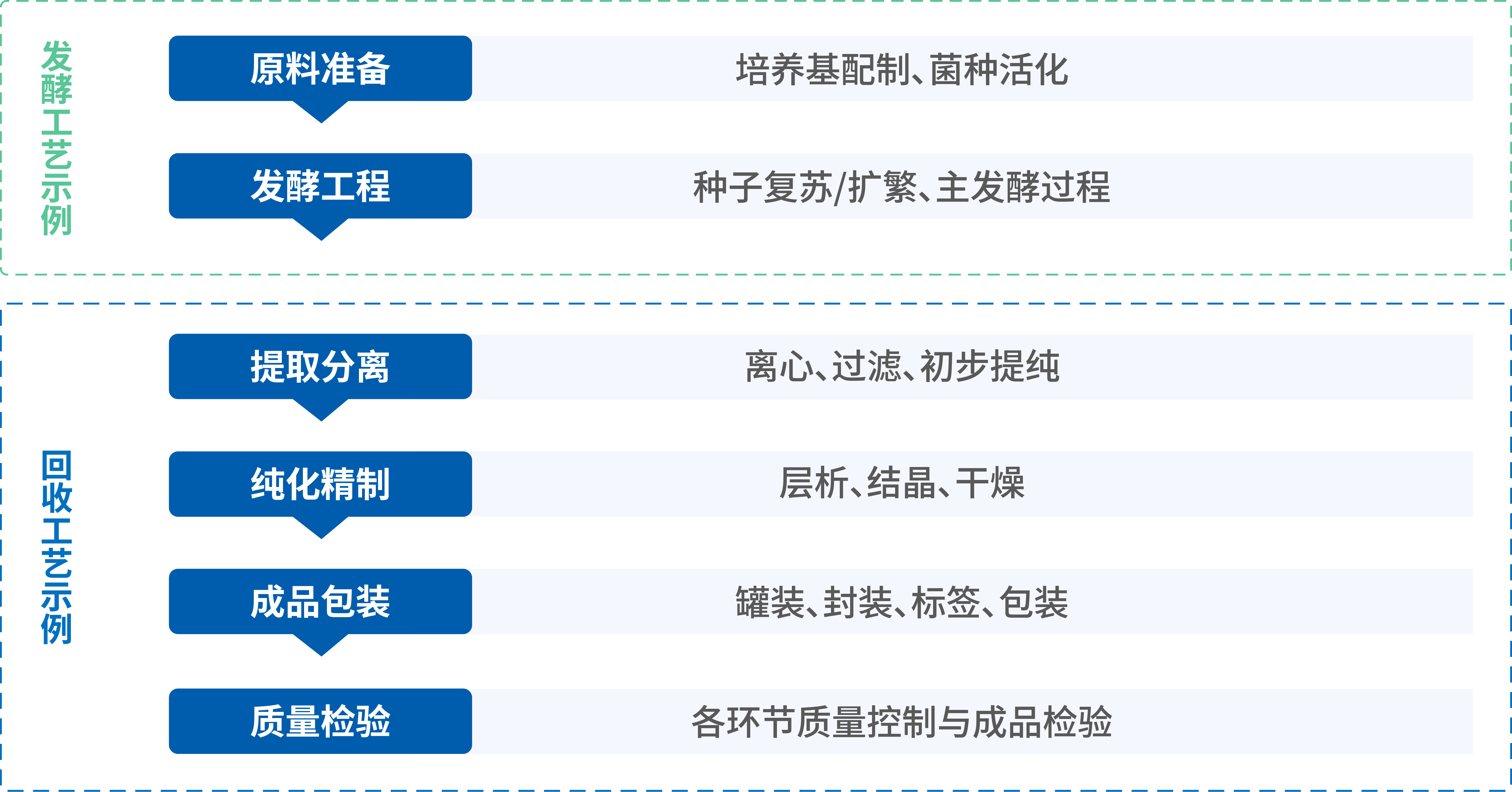
抗生素发酵和回收工艺[4]
风险评估内容—存在非内毒素热原(NEP)的可能性有多大?
• 生产工艺用菌株的特性:使用菌为G+或G-,评估是否可能含有脂磷壁酸(LTA)或肽聚糖等热原成分;评估特定蛋白表达水平(例外毒素、其他蛋白质)
• 发酵工艺残留革兰阳性菌(HKSA、LTA)、肽聚糖、酵母多糖等,都属于NEP。这些杂质与LPS协同刺激,可放大细胞因子含量,临床引发放大热原反应
• 评估培养基成分及来源:动物源性(是否存在病毒)、植物源性(是否存在霉菌毒素或是否为合成途径)
• 原材料的生物负载
• 生产工艺中潜在的交叉污染以及环境监测
• 下游工艺去除热原的能力
○ 用有机溶剂进行提取过程,该溶剂能溶解目标化合物但不会溶解水溶性热原物质
○ 过滤工艺用于分离如蛋白质或DNA/RNA等分子量较高的物质
○ 通过使用强酸或强碱来改变pH值,这可能会破坏某些热原物质(即目标化合物是稳定的)
风险评估方法[1]:
EP致热原性5.1.13指出对于那些无法排除存在NEP的药品,建议在进行BET的验证实验时,同时使用相同的3 批次进行MAT交叉验证实验。如果重要工艺参数发生变化,应再次在3批次上进行交叉验证。
EP11.8补编 2.6.30-6.5章节中关于NEP方法验证要求:
• 预实验应包括使用至少2种NEP配体(如肽聚糖、脂磷壁酸、合成细菌脂蛋白、鞭毛蛋白等)对检测系统进行验证,其中至少1种需加标至待检制剂中。
• 如有历史批次中已证实受NEP污染物污染的阳性样品,可优先使用;如无则可选择生产工艺可能引入的NEP对检测系统进行验证。
告别合规盲区!湖州申科为您的药品出海全程护航
湖州申科凭借自主研发试剂与深厚基质分析经验,能根据样品特殊性精准提供解决方案,直面欧美申报的“发补”要求。不仅助力企业完成关键技术变更(如多黏菌素B/E的RPT至MAT替换)与NEP风险评估(如盐酸表柔比星、重组抗体等),更能提供不同类型样品从前处理方法开发到申报支持的全套验证方案,从根本上化解合规的不确定性,高效推进产品出海进程。
PyroSup™ 热原检测试剂盒(MAT法)—试剂盒样品适用性
| 药物或原料 | 名称 | 检测试剂盒 | 前处理试剂盒 | ||||
| 抗生素 | 头孢唑肟钠 | 磷酸特地唑胺 | 法莫替丁 | 盐酸帕洛诺司琼 | 阿洛西林钠 | MAT试剂盒 | / |
| 头孢呋辛钠 | 硫酸阿米卡星 | ||||||
| 小分子药物 | 多黏菌素B&E | MAT试剂盒 | 前处理试剂A | ||||
| 盐酸表柔比星 | MAT试剂盒 | 前处理试剂B | |||||
| 单抗类 | 利妥昔 | 信迪利 | 阿达木 | 尼妥珠 | 雷珠 | MAT试剂盒 | / |
益赛普 | 瑞卡西 | 贝伐珠 | 依洛尤 | 阿利西尤 | |||
疫苗类 | 人用狂犬病疫苗 | 冻干甲型肝炎灭活 | 麻腮风联合减毒活 | 四价流感病毒裂解疫苗 | A群C群脑膜炎 | ||
流感病毒裂解疫苗 | 水痘减毒活疫苗 | ||||||
重组蛋白类 | 重组胰岛素注射液 | 特立帕肽注射液 | 重组人促红素注射液 | 重组人干扰素α-2b注射液 | 注射用重组IL-11 | ||
甘精胰岛素 | |||||||
血液制品类 | 人凝血酶原复合物 | 静脉注人免疫球蛋白 | 人凝血因子Ⅷ | 人血白蛋白 | |||
生化药品类 | 尿激酶 | 琥珀酰明胶 | 胶原酶 | 丁二磺酸苷蛋氨酸 | 谷胱甘肽 | ||
| 甲磺酸齐拉西酮 | 吲哚菁绿 | 甘露聚糖肽 | 烟酰胺 | 还原型谷胱甘肽 | |||
盐酸肾上腺素 | |||||||
注射液 | 参麦注射液 | 香丹注射液 | 生理盐水 | ||||
原辅料 | BSA | 胎牛血清 | 头孢噻肟钠 | 曲克芦丁 | |||
PyroSup™ 热原检测试剂盒(MAT法)
• 合规性与申报基石:细胞来源清晰,已获得商业授权,规避申报合规风险;
• 监管认可与性能稳定:联合权威机构进行全面性能验证,并经过客户及监管机构测试,其质量与性能优于其他同类型产品;
• 强大的技术解决能力:该细胞具备优异的技术适用性,搭配针对性前处理方案,可轻松突破检测场景限制;
• 经过实证的成功案例:已成功支持多个产品完成欧盟/FDA上市申报,拥有成熟的申报经验;
• 资质认证:通过ISO13485质量管理体系认证和CNAS实验室认可,中、美、欧三地申报拥有丰富经验。
参考文献:
[1] Europaea, P. (2025) 2.6.30. Monocyte-activation test-11.8.
[2] Source: EDQM; Animal Welfare Progress; PA/PH/SG (07) 8
[3] Europaea, P. (2020) 2.6.30. Monocyte-activation test
[4] Dr. Uwe Lipke | Phasing out the rabbit pyrogen test – the view from the perspective of antibiotics | 15.02.2023