产品中心
在检测复杂生物样品时,同质化程度高的单核细胞系检测稳定性相比混合细胞PBMC有着明显优势,面对复杂样品基质以及培养环境的波动影响表现出更好的耐受性。
那么,单核细胞活化试验检测(MAT)中,细胞孵育如何实现只识别热原相关分子,而不受样品基质干扰?Toll样受体(Toll-Like Receptors,TLRs)不可忽视。
01 如何攻克MAT检测适用性难题?精准评估TLRs是关键
TLRs是免疫细胞表面负责识别病原体的跨膜受体蛋白[1],广泛分布于细胞表面及胞内膜结构,这支“受体部队”由10种功能性亚型组成,通过协同作战实现对外源威胁的全面排查。
具体来看,各亚型的分布极具靶向性:TLR1、2、4、5、6部署在细胞表面,TLR3、7、8、9则位于胞内体[2],部分亚型还可在细胞膜与胞内体间灵活穿梭。这种精准的分布模式,正是其能“各司其职”精准识别不同外源性热原(PAMPs)的关键(详见表1[3])。
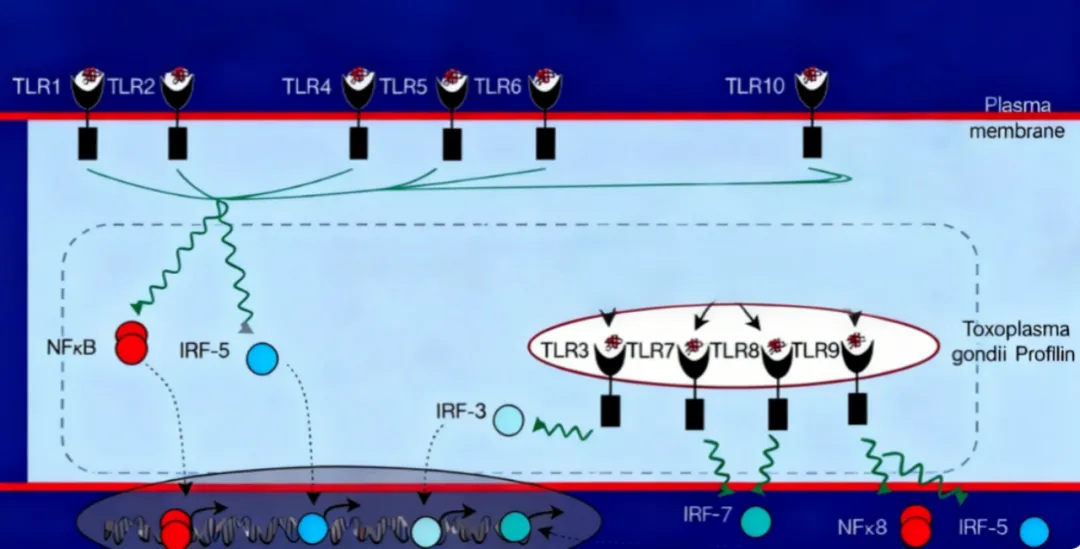
图1 TLRs在细胞中的位置示意图
表 1 TLRs亚型对应配体捕获一览表

一言蔽之,MAT单核细胞系对热原的免疫应答,实际全依赖于胞体的“斥候”部队—TLRs。当外源性热原与对应TLRs完成特异性结合后,一场免疫应答就此开始。
02 免疫应答24h:一场微观世界的“信息接力”
在MAT检测中,单核细胞与样品共孵育的24小时 ,正是这场免疫应答的关键阶段。
‣ TLRs与PAMPs结合后发生二聚化(homodimerization),其胞内TIR结构域随即化身“免疫信号检录处”,迅速招募适配器蛋白MyD88(髓样分化因子88);
‣ MyD88“检录通过”后,作为“第一棒接力员”启动信号传递,向下游传递“泛素化接力棒”[3];
‣ 核心“接棒手”IKK复合物接到信号后,即刻磷酸化NF-kB的抑制因子IkB,使NF-kB得以释放;
‣ 随后,“终末信使”NF-kB冲入细胞核[3],启动炎症因子相关基因转录程序,驱动TNF-α、IL-1β、IL-6等细胞因子(内源性热原)的表达[4]。
至此,一场精密衔接的免疫信号传递过程全部完成,最终激活机体形成对炎症与感染的系统性防御,并引发包括发热在内的多种生理反应,而这些细胞因子也构成了MAT检测中关键的热原标志物。
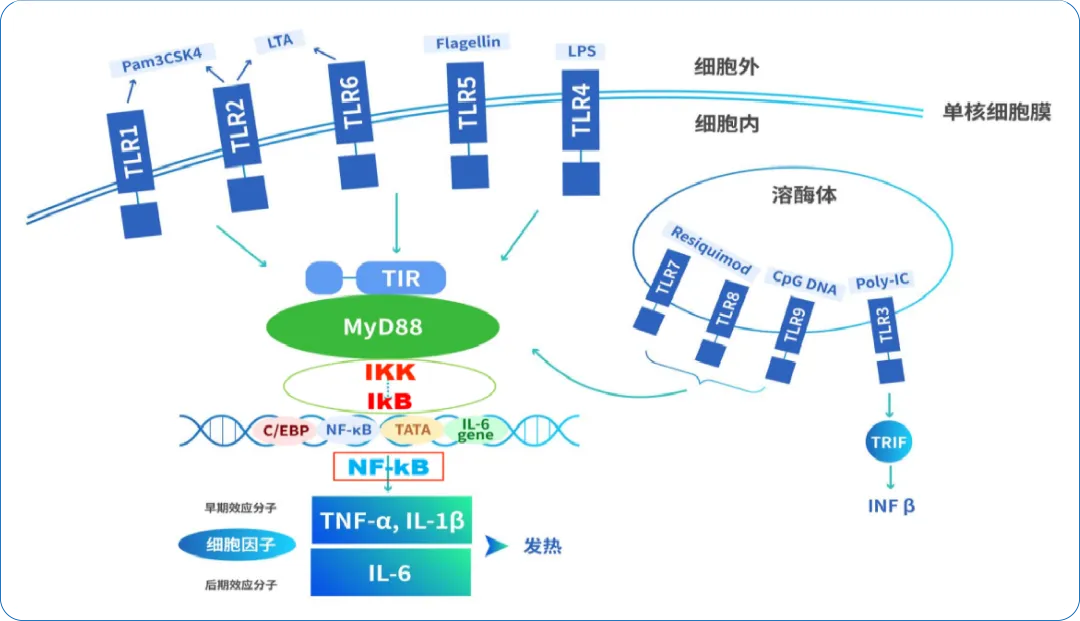
图2 免疫应答传递示意图
03 精准评估TLRs:打响单核细胞免疫应答首战
PyroSHENTEK™热原检测试剂盒中的单核细胞系,采用Western blot技术,对TLR跨膜蛋白进行了系统性的验证(如图3所示)。
该过程相当于构建细胞的“全域感知网络”,使MAT细胞凭借完整的TLR表达谱,全面覆盖不同类型热原的识别需求,从源头奠定检测能力的坚实基础。

图3 PyroSHENTEK™ MAT细胞TLRs检测结果
细胞对热原的响应能力,高度依赖其反应速度与作用效率。相关研究为此提供了关键理论支持,证实单核细胞在LPS等热原配体诱导下的分化过程,具有明确的浓度与时间依赖性[2]。
在广泛文献研究的基础上,结合对免疫应答机制的深度分析,PyroSHENTEK™热原检测试剂盒优化并确立了MAT细胞分化诱导的关键参数,显著提升了细胞在复杂样品环境中的响应能力(样品适用性数据详见表2),并在不同浓度的非内毒素热原检测中也表现出良好的响应特性(结果详见图4)。
表2 申科MAT样品适用性列表
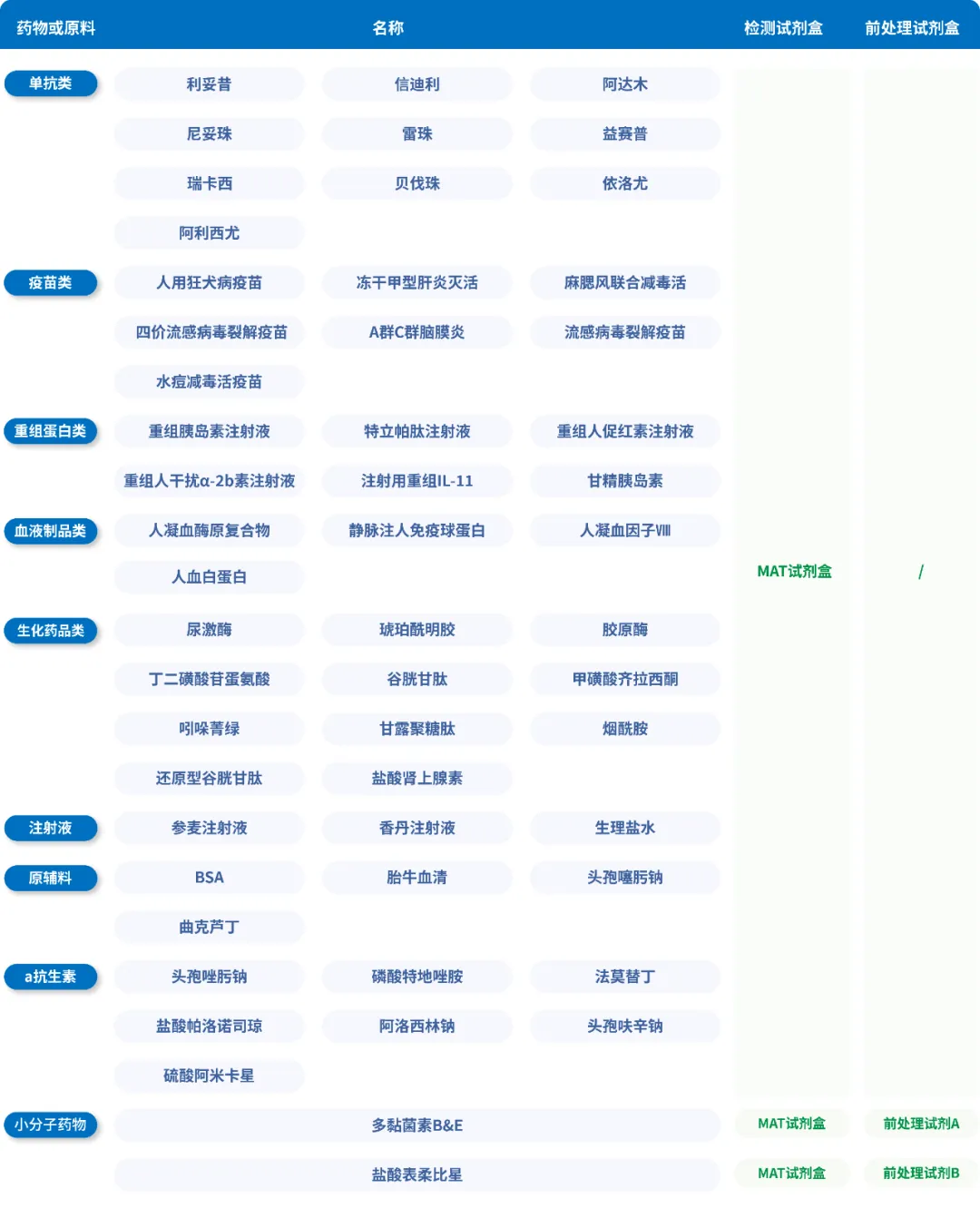
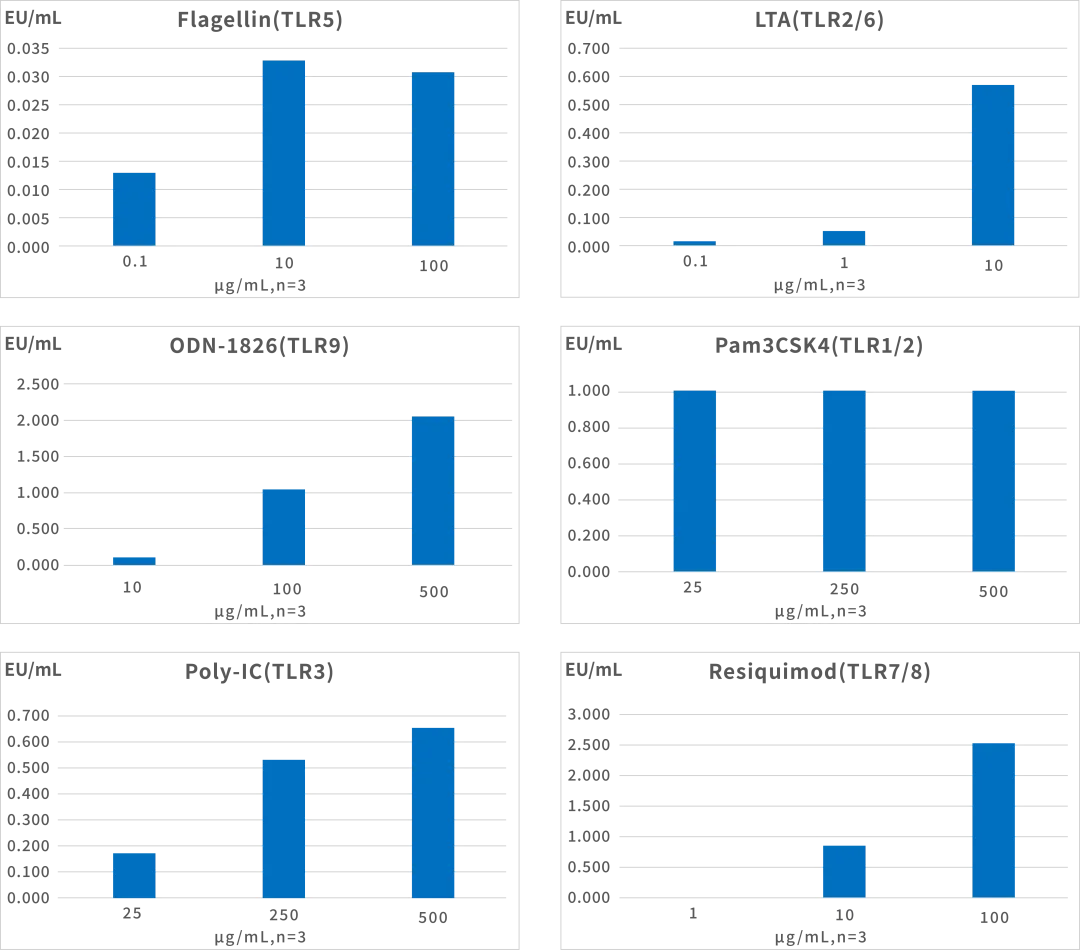
图4 PyroSHENTEK™ MAT细胞针对不同类型及浓度Non-Endotoxin Pyrogens(NEP)的响应反馈
04 PyroSHENTEK™ 热原检测试剂盒(MAT 法)
• 合规溯源筑根基:细胞获商业授权,溯源链条清晰可查,完全匹配申报合规要求,从源头规避风险;
• 多维特训拓边界:聚焦细胞性能优化、样品前处理升级双维度,以 “特训策略” 持续突破检测场景限制,拓展适用范围;
• 稳定质量强支撑:通过全面性能验证,且经监管机构与客户双重测试认证,性能表现稳定可靠,保障检测结果一致性;
• 实战案例证实力:拥有欧盟市场成功申报案例,将实验室的科学优化转化为落地可行的解决方案。
参考文献:
[1] Kaczmarek, A., et al. (2020) ‘Expression of surface and intracellular Toll-like receptors by mature mast cells’, PubMed. Available at: https://pubmed.ncbi.nlm.nih.gov/28450795/ (Accessed: 24 October 2025)
[2] Mita, Y., Dobashi, K., Nakazawa, T. and Mori, M. (2001) ‘Induction of Toll-like receptor 4 in granulocytic and monocytic cells differentiated from HL-60 cells’, British Journal of Haematology, 112(4), pp. 1041–1047. doi: 10.1046/j.1365-2141.2001.02658.x. Erratum in: British Journal of Haematology, 115(3), p. 715. PMID: 11298604
[3] Blasius, A.L. and Beutler, B. (2010) ‘Intracellular toll-like receptors’, Immunity, 32(3), pp. 305–315. doi: 10.1016/j.immuni.2010.03.012. PMID: 20346772
[4] Tanaka, T., Narazaki, M., Masuda, K. and Kishimoto, T. (2016) ‘Regulation of IL-6 in Immunity and Diseases’, Advances in Experimental Medicine and Biology, 941, pp. 79–88. doi: 10.1007/978-94-024-0921-5_4. PMID: 27734409