产品中心
生物制品浪潮下,单抗、疫苗等制剂的内毒素检测迎来更严格的质量要求——内毒素“遮蔽” 引起的低内毒素回收(LER)而造成内毒素检测假阴性风险,正成为药企申报的重大挑战。
自2013年4月首次报告LER现象以来,LER在生物制剂或蛋白药品中得到了广泛的报道和研究。为此,FDA首先提出了企业要建立基于实验室数据的细菌内毒素分析样品储存与处理程序,即每种产品均需开展保留时间研究(Hold-Time Study)。
1. LER全球监管要求
• 美国FDA:2013年开始要求在生物药递交注册申请(BLA)时, 需要递交LER研究报告。
• 欧洲EMA:2023年发布的《生物制品问答》中提到,对于含表面活性剂(如聚山梨酯)和螯合剂(如EDTA、柠檬酸盐、磷酸盐、组氨酸)的制剂,在提交上市许可申请时需提交LER研究数据。
• 中国药典:2025版《中国药典》9251 细菌内毒素检查法应用指导原则已新增低内毒素回收(LER)相关内容。
• 药品GMP指南(第2版)《无菌制剂》下册《生物制品(单抗)细胞治疗产品》中“下游工艺的生产质量控制”中列出关于低内毒素回收的相关要求。
2. LER现象定义
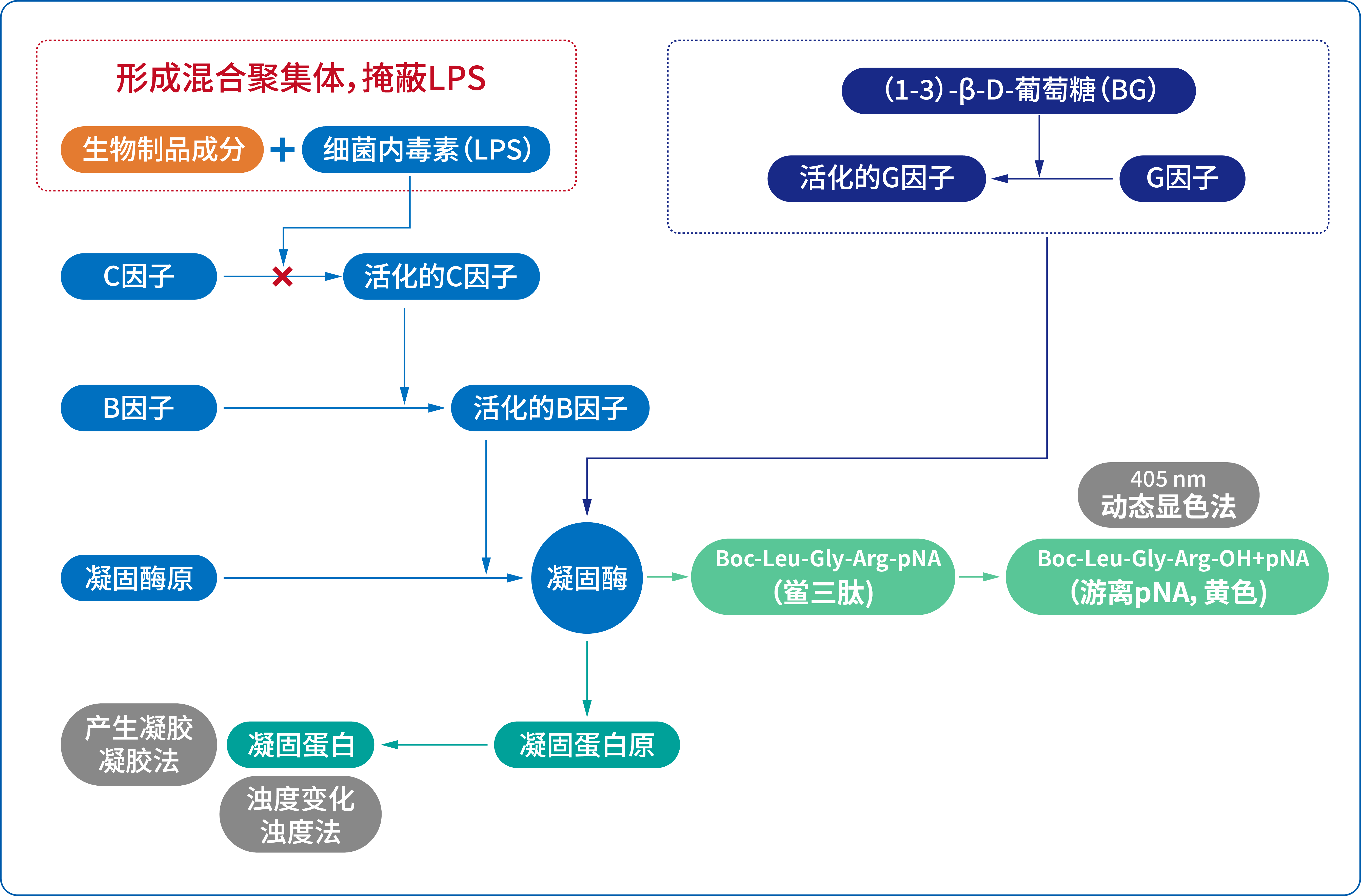
低内毒素回收(LER)现象是指:随着时间推移,药品或制剂经细菌内毒素检查法(BET)检测多个时间点未稀释产品中添加的内毒素标准品(CSE)时,连续两个时间点回收率小于50%。
3. LER现象发生在哪里?
迄今为止,对LER的关注主要与生物制品有关。特别是单克隆抗体或治疗性蛋白质,因为它们在生产过程中经常需要聚山梨酯来防止蛋白质聚集,并需要螯合生物缓冲液来维持最佳pH值。
① 目前主要在生物制剂生产的背景下讨论LER
② 也有一些证据表明含组氨酸的制剂偶尔也可能导致LER
③ 约70%以上的蛋白质制剂中使用聚山梨酯
④ 常见的生物辅料,结合了螯合剂(枸橼酸盐或磷酸盐缓冲液)的聚山梨酯已被确认会导致LER
⑤ LER被认为与鲎试剂中常见的干扰不同,无法通过常用的稀释或其他样品制备方法克服
4. LER VS 常规内毒素检测干扰的区别
各国药典要求内毒素检测时,可将样品进行稀释直至无干扰,无干扰的检测要求是内毒素回收率在50%-200%之间。但研究表明,LER是无法通过稀释样品来解决内毒素检测回收率达到50-200%,其是一个与温度和时间相关的现象。

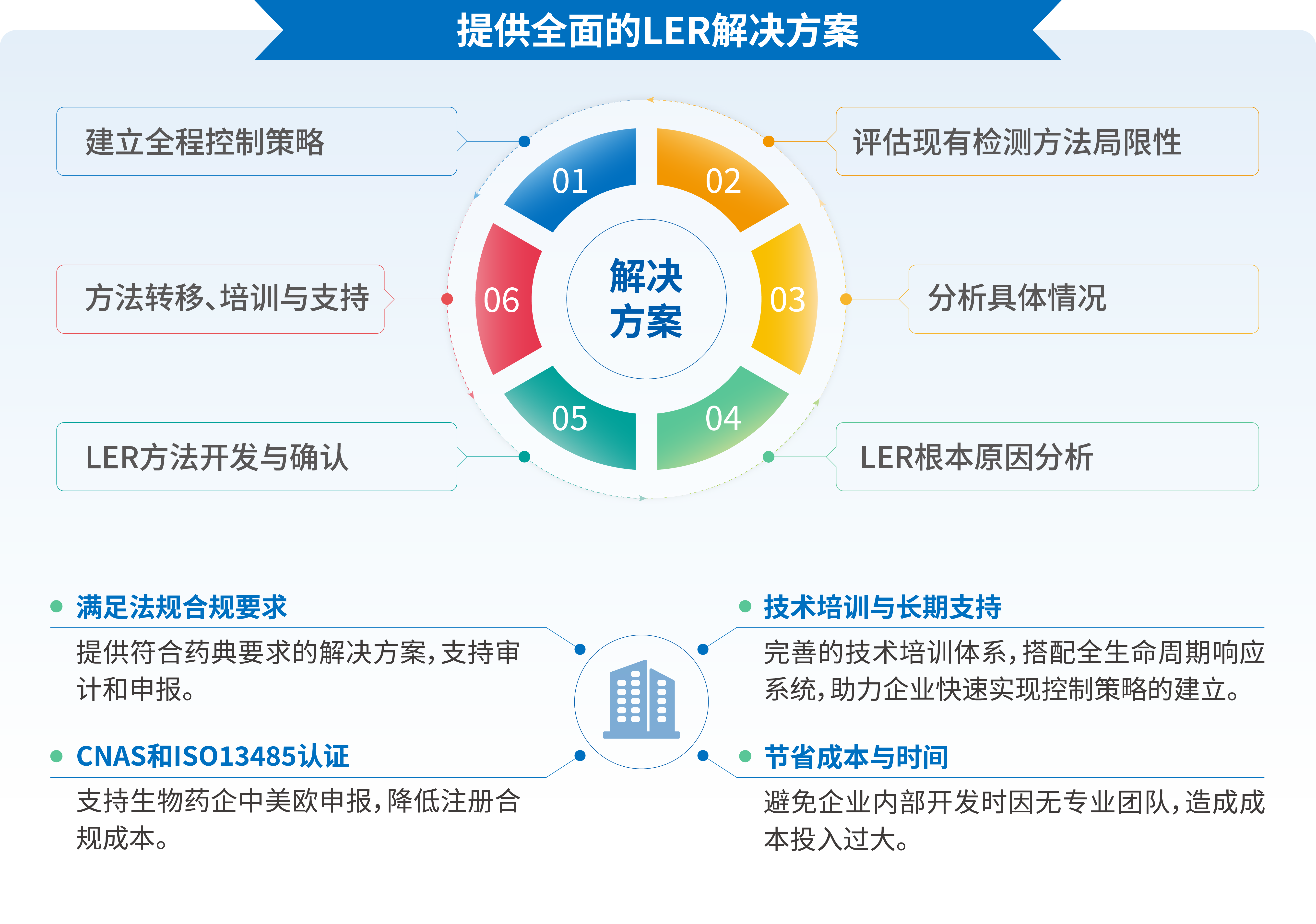
5. LER解决方案:标准化研究流程与创新技术支持
湖州申科依托完整的热原产品线(含检测试剂、标准品、前处理试剂等),提供从基础内毒素检测到复杂LER问题专项技术研究的完整解决方案,快速响应,精准匹配。
• MAT检测试剂盒:内毒素检测+非内毒素检测
• 重组级联试剂(rcR):有效减少G因子假阳性和LER
• 鲎试剂(动态显色法):产品过程监控
• 鲎试剂(凝胶法):快速便捷
6. 应用案例
湖州申科自主创新,开发了多个样品前处理试剂,针对具体样品,已成功为国内用户提供了可缓解LER现象的内毒素检测试剂,并用于国外申报。
这些试剂可适用于因表面活性剂或蛋白引起的内毒素掩蔽,相比同类鲎试剂具有更强的LER缓解能力,适配于动态显色法试剂盒。
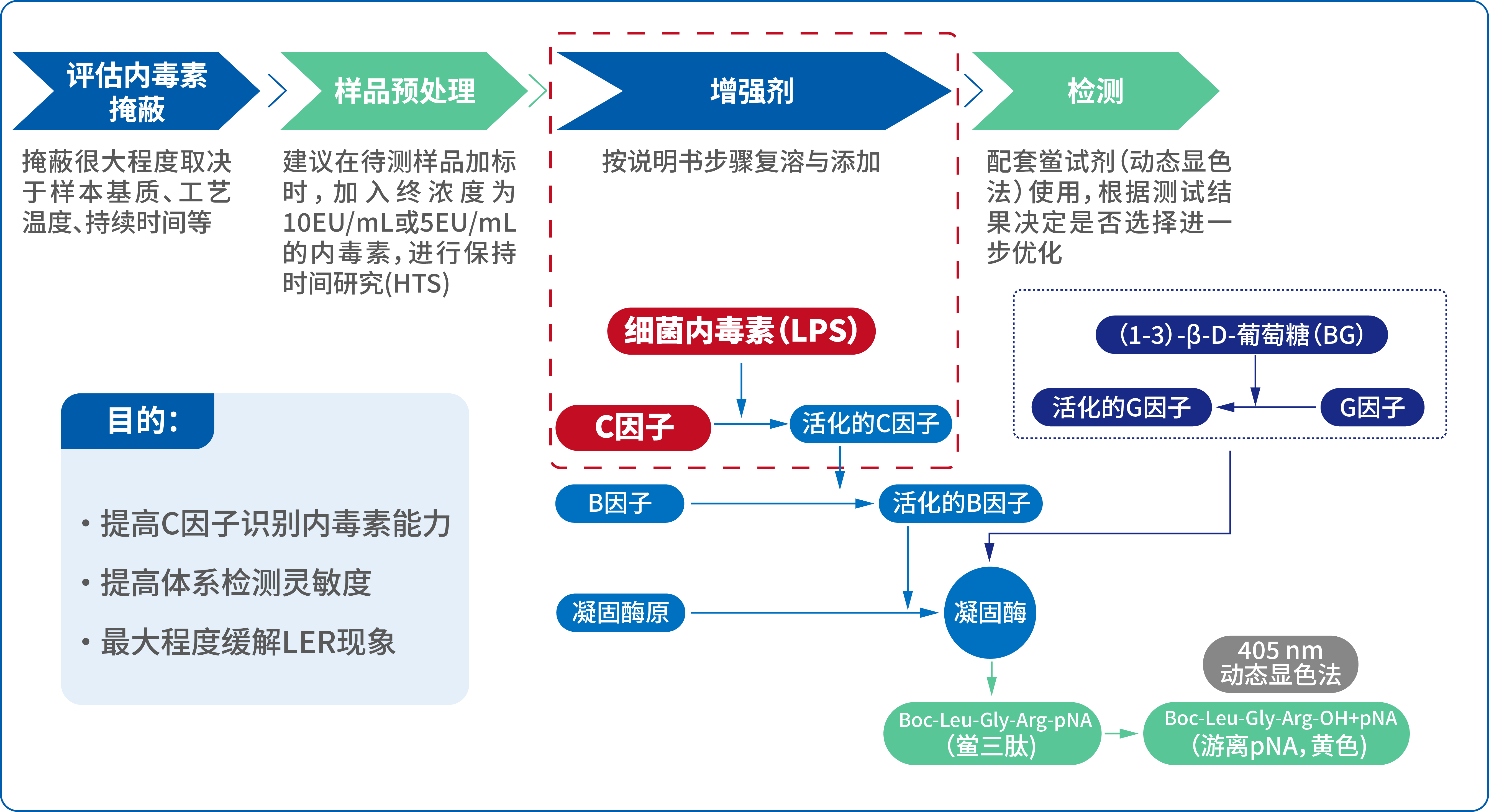
湖州申科鲎试剂(动态显色法)LER缓解
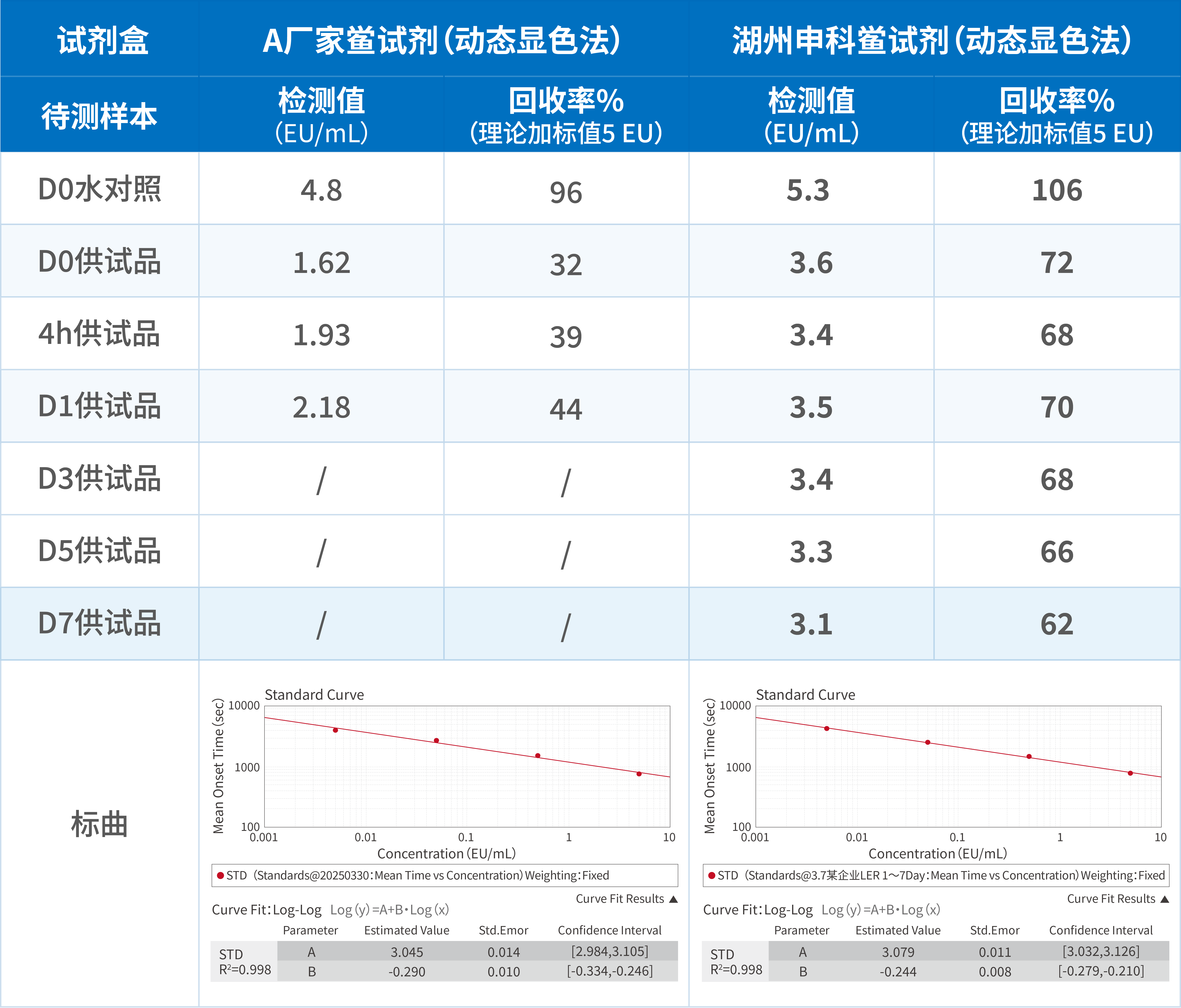
LER实际解决案例(已成功海外申报)
7. 结语
造成LER现象的原因千差万别,目前业内没有单一的解决方案,需针对具体样品探索不同的前处理方法、加样/保持时间研究及不同方法学检测,以寻找最佳方案。
同时,LER 风险不应仅关注终产品,还需前移至生产过程,以避免热原漏检影响用药安全,阻碍申报进程。