产品中心
在基于核酸扩增技术(NAT)的支原体检测中,检测限(LOD)常被视作方法灵敏度的核心指标。然而,在实际的方法学验证与应用中,一个常被忽视的问题是:LOD的可靠性首先取决于支原体菌株的质量。
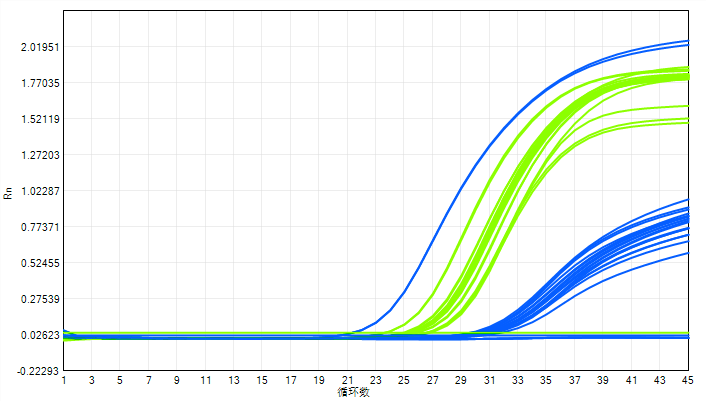
支原体检测qPCR扩增
01 NAT检测的本质:检测支原体核酸
与培养法不同,NAT方法直接检测支原体DNA信号,这意味着:
• NAT无法区分活菌与死菌
• 检测结果高度依赖样品中的基因拷贝数(GC)
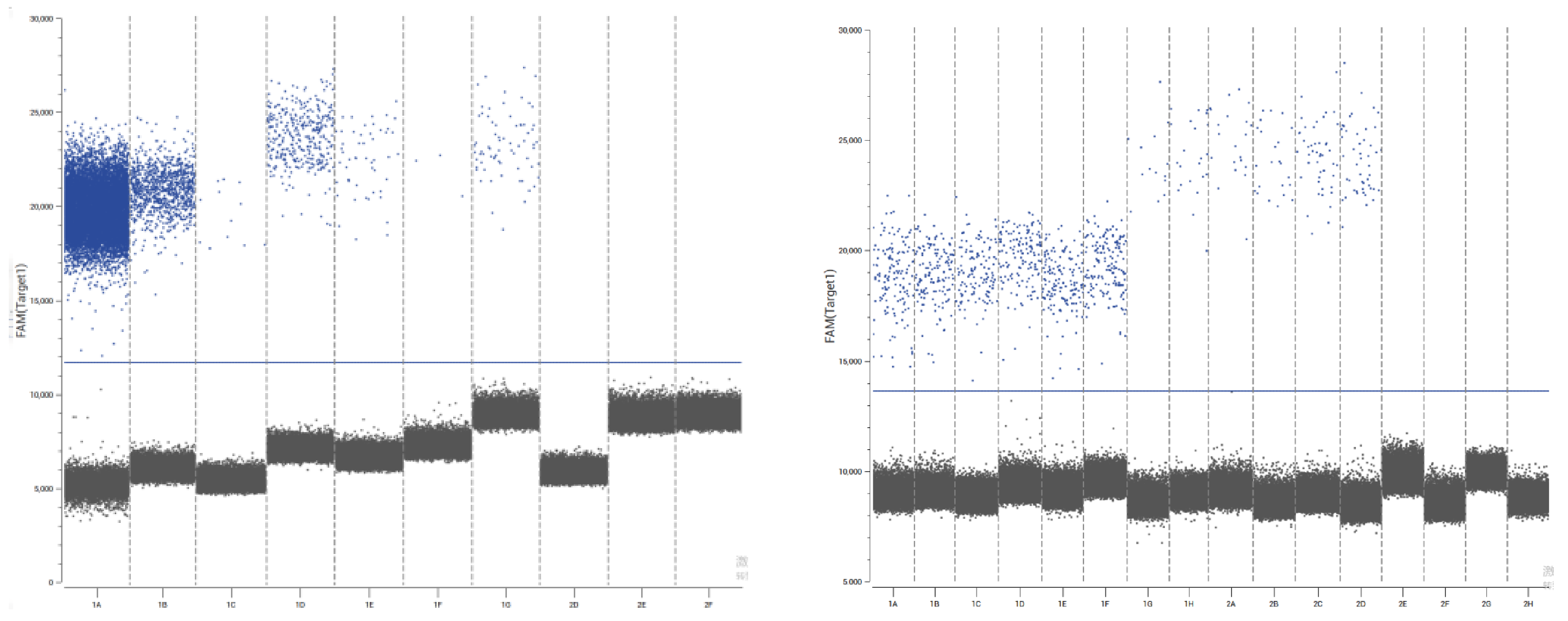
dPCR检测支原体GC
对于支原体菌株,行业通用的生物学定量单位是菌落形成单位(CFU),关键在于,GC与CFU之间并不存在恒定比例关系。
02 GC/CFU比值:影响LOD的关键但隐蔽因素
在支原体菌株制备过程中,常面临以下挑战:
• 支原体易聚集,难以均匀分散。
• 不同种类支原体培养条件差异大,工艺复杂。
• 支原体个体微小,不易直接观察计数。
• 培养过程中容易产生死菌。
• 死菌会释放游离DNA,显著抬高GC含量。
当GC/CFU比值过高时:
• LOD在数据上看似更低。
• 实际检测信号可能主要来源于死菌核酸。
• 对于核酸检测而言,高浓度的检测对于检测体系要求反而更低。
• 导致核酸法灵敏度被“虚假放大”。
03 行业共识:并非所有菌株都适合用于LOD验证
• 当前行业普遍认同:
○ ATCC提供的标准支原体菌株在一致性和可追溯性方面更具优势。
○ 多数合格菌株的GC/CFU比通常控制在10以下(除非另有说明)。
○ 应选择适用于NAT方法LOD验证和方法学确认的菌株。
• EP 2.6.7草案(Pharmeuropa 36.1)对于菌株的要求:
○ 支原体应在生长的指数阶段收获,以保证菌株活性。
○ 应在冻存工作悬浮液/稀释液之前测定CFU。
○ CFU的测定应进行一定数量的重复。
○ 对于基因组拷贝数(GC)的测定,必须同时考虑上清和细胞这两种组分。
○ 确定GC/CFU比值的接受标准:除非另有说明,否则参考品的GC/CFU比值应小于10。
• USP 77征求意见稿菌株要求:
支原体培养物应进行计数,并对基因组拷贝(即其GC/CFU比值)进行表征。
• JP G3-14-170菌株要求:
应预先建立菌株库CFU和核酸拷贝数之间的关系(即GC/CFU比值)。
04 为什么菌株质量对QC与法规合规至关重要?
在核酸法支原体检测中,我们不仅应当关注方法是否“足够灵敏”,更要关注:
• 灵敏度是否真实反映污染风险?
• LOD是否建立在生物学真实的验证基础之上?
菌株质量是连接方法性能与放行风险的关键桥梁。此外,标定菌株所用的测试方法是否经过验证,也严重影响了菌株的质量。
• 培养体系是否经过验证,以确保培养基的检测灵敏度。
• GC测定方法是否经过验证,以保证结果的可靠性(不同的GC测定方法可能导致结果差异)。
05 核心结论:
支原体核酸检测,只有基于高质量菌株基础上的低LOD,才具有真正的质量意义。