产品中心
在生物制药和生物检测领域,支原体污染常被视为隐藏的“沉默杀手”。这种微生物无细胞壁、体积微小(0.1-0.8 μm),能够穿透常规0.22 μm滤膜。其污染初期通常无明显症状,但一旦爆发,会导致细胞代谢紊乱、基因表达异常,甚至可能威胁患者的生命安全。因此,支原体检测在生物制药和生物检测行业中显得尤为重要。
支原体污染:生物制药领域的重大挑战
1.细胞治疗与支原体污染
细胞治疗作为肿瘤免疫治疗领域的国际研究热点,近年来发展迅速。细胞和基因治疗产品层出不穷,以活细胞制剂为主要形式,用于治疗或预防疾病[1]。细胞培养的质量直接关系到药品的安全性。自1956年研究人员首次在细胞培养中发现支原体污染以来,支原体污染检查一直是生物制品外源因子污染检查的重要内容,也是生物制品生产中面临的重大挑战之一[2]。
据相关研究显示,早在1993年,美国FDA实验室的两万个Hela细胞培养物中就有15%受到了支原体污染。操作环境、操作人员及其习惯、交叉污染以及受污染的原辅料等都可能导致支原体污染,污染率高达15%-80%。支原体污染不仅会严重影响细胞的生长和代谢,还会降低生物药的质量和产量,最终对使用患者产生副作用。因此,为保证生物药的质量安全,必须对细胞库、病毒种子批次和终产品进行支原体污染检测。
2.支原体检测的法规要求
支原体检测是保障生物制品安全的重要环节。在检测过程中,需使用已知的支原体菌株作为对照品,通过与已知支原体菌株的比对,判断样本中是否存在支原体污染。我国药典及国际药品监管机构认可的支原体检测方法为传统法(培养法和指示细胞法)。然而,培养法检测周期较长,指示细胞法灵敏度较低,在活细胞制剂终产品的快速放行检测中存在一定的局限性。
因此,核酸扩增技术(NAT)作为一种替代方法应运而生。NAT检测方法的灵敏度达到10 CFU/mL,可替代培养法;达到100 CFU/mL时,可替代指示细胞培养法。目前,EP、JP以及USP均已收录NAT方法作为支原体检测方法。
支原体菌株:检测方法的质量基石
随着生物制药行业的快速发展,对于支原体的检测需求迅速扩张。2023年,美国国立卫生研究院(NIH)实验医学部门对五种商业化支原体检测试剂盒进行了比较测试,其相关结果发表在Journal of Clinical Biology杂志上[3]。
1.商业化试剂盒的比较与挑战
这些试剂盒包括:MycoSEQ支原体检测试剂盒(赛默飞,美国),VenorGEM支原体检测试剂盒(MB,德国),MycoTool 支原体检测试剂盒(罗氏,瑞士),ATCC支原体检测试剂盒(ATCC,美国),Biofire支原体检测系统(生物梅里埃,法国)。研究者使用自制的十种支原体菌株测试了这些试剂盒的检测限,对其灵敏度进行考察。结果显示,并非所有试剂盒均能达到检测限≤10CFU/mL,且五种试剂盒对相同菌株的检测限并不完全相同。任意两种试剂盒相互比较时,无法满足检测不同菌株灵敏度完全一致的要求。
支原体检测限度在不同试剂盒中的测试汇总[3]
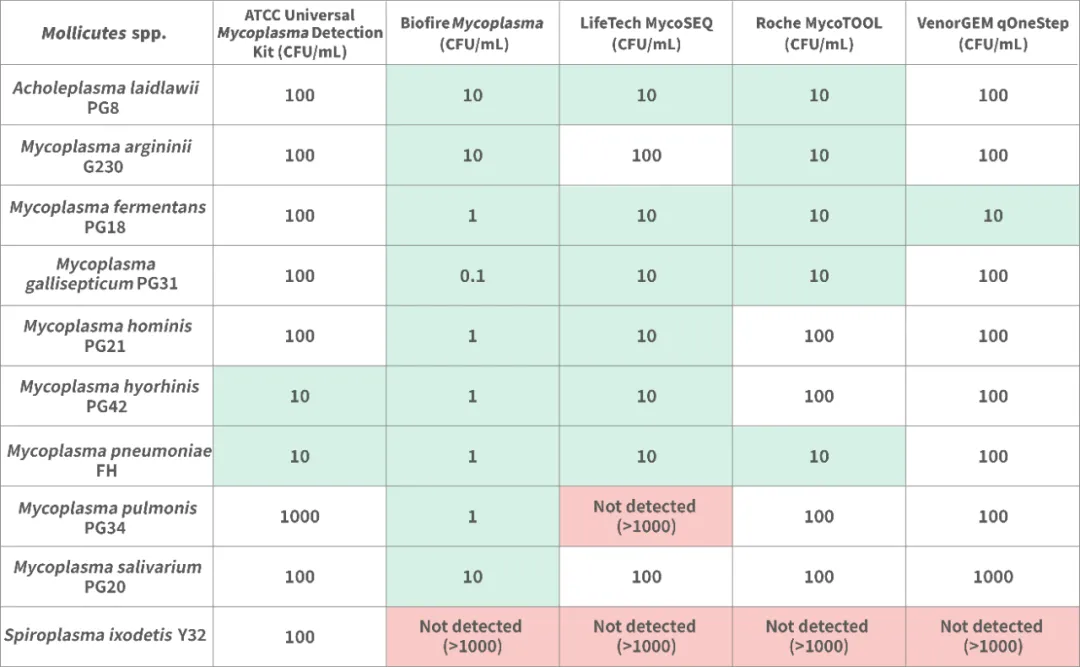
2.Biofire支原体检测系统的创新与启示
在上述研究中,生物梅里埃公司生产的Biofire支原体检测系统表现出最高的灵敏度。Biofire采用一体化检测系统,实现取样量的100%进样和全检测,为行业开发支原体检测提供了新的思路。根据Biofire支原体检测系统的使用说明,其样品可直接进样量为0.2 mL;如果检测灵敏度≤10 CFU/mL时,需要首先进行10mL取样,离心浓缩到0.2 mL。而在此文章中,其按照0.2 mL直接取样,在检测鸡毒支原体时,检测限可达0.1 CFU/mL。
然而,从取样的现实角度考虑,取样量为0.2 mL时,检测出样品中含有0.02CFU是非常困难的。推断此结果可能是因为文章中自制菌株的GC/CFU比值偏高导致。据EP 36.1 支原体草案规定,GC/CFU比值的接受标准除非另有说明,否则其GC/CFU比值应小于10。
因此,支原体标准菌株对支原体检测试剂盒的选择、使用及验证至关重要。制定严格的质量控制标准更为重要,质检合格的支原体标准菌株是进行支原体相关实验的关键前提。只有在保证菌株实际含量与标示值/理论含量一致时,验证及检测结果才有效。
技术驱动下的行业标准化
在技术的推动下,支原体检测行业正朝着标准化方向发展。支原体标准菌株在生物制药与生物检测行业中承担着关键角色,其重要性将随着生物制品的发展而愈发凸显。
1.支原体标准菌株
ChP、EP、JP以及USP均推荐使用猪鼻支原体、口腔支原体、肺炎支原体等作为标准菌株,用于NAT方法检测限的验证。湖州申科拥有成熟稳定的支原体菌株生产制备工艺,并制定了严格的质量控制标准;提供这三种支原体菌株(10/100 CFU)及DNA校准品,均可溯源至保藏机构,且正式授权。
此外,湖州申科已获得其他多种支原体菌株的正式授权,并即将推出莱氏无胆甾原体、唾液支原体、发酵支原体、人型支原体、精氨酸支原体、鸡毒支原体、柠檬螺原体、滑液支原体等多种支原体菌株。
2.MycoSHENTEK®支原体一体机检测系统
湖州申科自主研发推出了一体化支原体检测仪器和配套试剂盒,采用一体化检测系统,最大上样量为1 mL,实现100%进样和全取样量检测,4通道或16通道并行检测,满足生物制品QC要求;并且仅加样一步开盖,大大减少了交叉污染的风险,降低了实验环境及人员操作的要求,显著提高了结果的稳定性和放行速度。
3.高质量检测服务
湖州申科不仅提供高质量的支原体标准菌株,还为客户提供高质量符合法规要求的检测服务;为客户设计符合药典规定的实验方案,涵盖样品检测、样品适用性验证及支原体qPCR法方法学验证等内容,满足国内外申报所需。从需求评估到交付,湖州申科为客户提供全流程解决方案,精准攻克项目难题,满足生物制药企业在不同阶段的质量控制需求。
随着生物制药行业的快速发展,支原体检测技术也在不断创新。未来,湖州申科将继续致力于支原体检测技术的研发和创新,不断提升检测平台的能力和服务质量。
无论是生物制药行业为了保证药品质量,还是生物检测行业为了提升检测的准确性和可靠性,支原体菌株的使用都有着极高的要求和必要性。
参考文献:
[1] 陈耐寒,撒亚莲.细胞制剂支原体检测方法概述[J].检验医学, 2022, 37(7):684-687.
[2] 赵翔,冯建平,孟淑芳.支原体检查的核酸检测方法及方法学验证的思考[J].中国药事, 2018, 32(8):1020-1027.
[3] Arthur H. Totten, Anna Julia Adams, Hyunmi K. Halas, et al. Comparison of Five Commercial Molecular Assays for Mycoplasma Testing of Cellular Therapy Products [J]. Journal of Clinical Microbiology, 2023, 61(2):1-11.