产品中心
细胞和基因治疗产品推陈出新,预计到2025年,FDA每年将批准上市10-20个细胞和基因治疗产品。细胞基因治疗产品可分为:干细胞、免疫细胞、基因治疗和组织工程细胞等。近年来,以CAR-T为代表的免疫细胞,以间充质干细胞为代表的干细胞,AAV基因治疗及溶瘤病毒等这些新型生物制品同样在国内如火如荼地开展。
这些生物制品,不同于传统制药,给生物制药企业带来了一系列挑战,对于新的测试方法的需求日益增长并提出全新的要求。
▸ 这些产品量少,批产量不大,批次多。并且,大多需要检测的样品中存在活细胞,可能高达10⁷;
▸ 样品基质复杂,如高蛋白,对于传统培养方法来说因为基质的问题,存在较大干扰或抑制,也需要通过增加传代培养步骤来消除影响,从而可能导致检测时间在原来的基础上延长2-3周。
新型生物制品的终末灭菌存在极大挑战,质量安全控制需要从起始材料、原物料、全工艺过程进行严格控制以确保免除微生物的污染风险。
在此过程中,支原体污染的风险极其高。支原体的污染难以察觉,对生物制品生产质量影响极大,因此,各国药典和药品监管法规对生物制品生产中的支原体检查都作出了明确规定,如EP 2.6.7 MYCOPLASMAS,USP <63> MYCOPLASMA TESTS,《中国药典》3301 支原体检查法。

支原体检查方法
支原体传统检查方法有:培养法、指示细胞培养法,其检测时间长14-28天不等。培养法需要阳性活菌作参照,每批次培养基需要做灵敏度测试,因此一个完整的合规的支原体培养法检查周期至少需要21-35天。为此,各国药典都提出了支原体核酸检测(NAT)方法,如EP 2.6.7 MYCOPLASMAS,USP <77> Mycoplasma Nucleic Acid Amplication Tests,JP <G3-14-170>Mycoplasma Testing for Cell Substrates used for the Production of Biotechnological/Biological Products ,《中国药典》3301 支原体检查法“也可采用经国家药品检定机构认可的其他方法”,并明确规定NAT法可用于替代方法培养法,检测限应能检测到10 CFU/mL;可用于替代方法指示细胞培养法,检测限应能检测到100 CFU/mL。
MycoSHENTEK®支原体qPCR检测试剂盒(2G)
MycoSHENTEK®支原体检测符合EP 2.6.7中对于支原体验证的所有要求,其检测灵敏度、特异性、耐用性皆按照药典要求进行完整方法性能验证,可以替代培养法和指示细胞培养法。针对生物制品中特殊复杂的样品基质,如10⁷细胞基质,全血,高浓度质粒(1 mg/mL),人白基质等,推出第二代MycoSHENTEK®支原体qPCR检测试剂盒(荧光探针法),进行了全面的方法性能验证。
| 货号 | 产品名称 | 规格 |
| 1509840 | 支原体DNA提取纯化试剂盒(2G) (磁珠法) | 50 Extractions |
| 1509841 | 支原体DNA检测试剂盒(2G) (PCR-荧光探针法) | 50 Extractions |
| 1509102 | 支原体DNA提取纯化试剂盒 (磁珠法)(快速版) | 50 Extractions |
| 1509101 | 支原体DNA检测试剂盒(PCR-荧光探针法)(快速版) | 50 Extractions |
产品特点:
• 快速:样品经前处理后直接进行qPCR检测,全程4小时。
• 避免污染风险:含dUTP/UNG,灭活的阳性菌质控。
• 高灵敏度: 多种支原体菌株验证,灵敏度达10 CFU/mL。
• 符合法规:完整验证检测方法和过程(包括前处理),可提供验证报告,符合法规要求。
• 设计可靠:含内部质控(IC)和阴、阳性质控(PC、PCS、NCS、NTC),避免假阴性和假阳性。
• 样本适用性广:可用于各种样品类型的检测(病毒、10⁷细胞、培养液、制品、5%人白、全血、1 mg/mL质粒等样品)。
• 覆盖范围广:目前可查询到的170多种支原体、螺原体和无胆甾原体。
• 效率高:采用双重荧光PCR,单个反应孔同时检测支原体信号和内控信号。
• 质量保证:ISO13485体系认证,GMP-like生产,提供质检报告及菌株溯源。
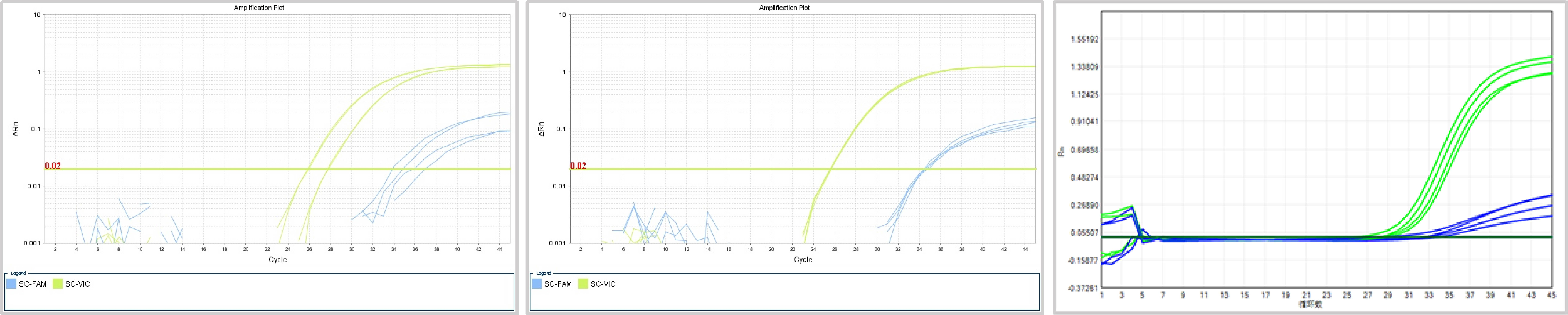
左:10⁷个细胞(CHO-S&Vero)基质下的10 CFU/mL支原体qPCR检测扩增线;
中:5%人血白蛋白基质下的10 CFU/mL支原体qPCR检测扩增线;
右:全血基质下的检测结果 100 CFU/mL支原体qPCR检测扩增线结果,蓝色:FAM信号,绿色:VIC信号。