产品中心
生物制品中的重组蛋白药、抗体药、疫苗等产品是用连续传代的动物细胞株表达生产,虽然经过严格的纯化工艺,但产品中仍有可能残余宿主细胞的DNA片段,这些残余DNA可能带来传染性或致瘤性风险,因此,各国法规都对宿主细胞DNA残留都有限制要求。
湖州申科利用自主研发生产的各种宿主细胞残留DNA检测试剂盒为客户提供样本检测服务和样本适用性验证服务,包括CHO、E.coli、毕赤酵母、Vero、NS0、SP2/0、Human(含293、293T、Hela、MRC-5等人源细胞)、MDCK、Sf9、Hi5等常见工程细胞或工程菌来源的残留DNA。
以质粒样本为例,对样本适用性验证和样本检测进行说明:
样本适用性验证结果:
· 中间精密度

· 重复性
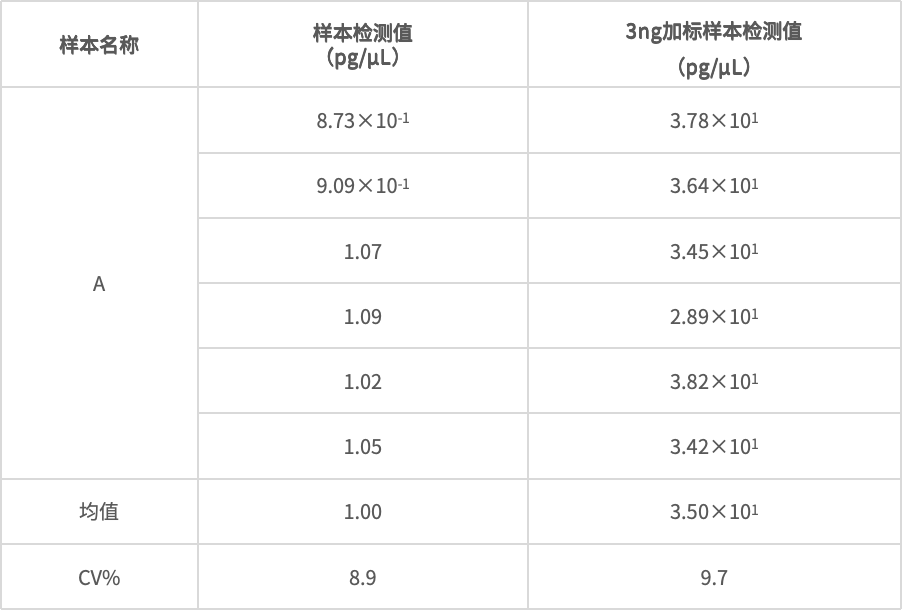
· 准确性

◆ 0.3 ng为低浓度加标量,是处理样本中DNA残留量的2-10倍;
◆ 3 ng为中浓度加标量,比低浓度加标量高一个数量级;
◆ 15 ng为高浓度加标量,比中浓度加标量高一个数量级。
样本检测结果:
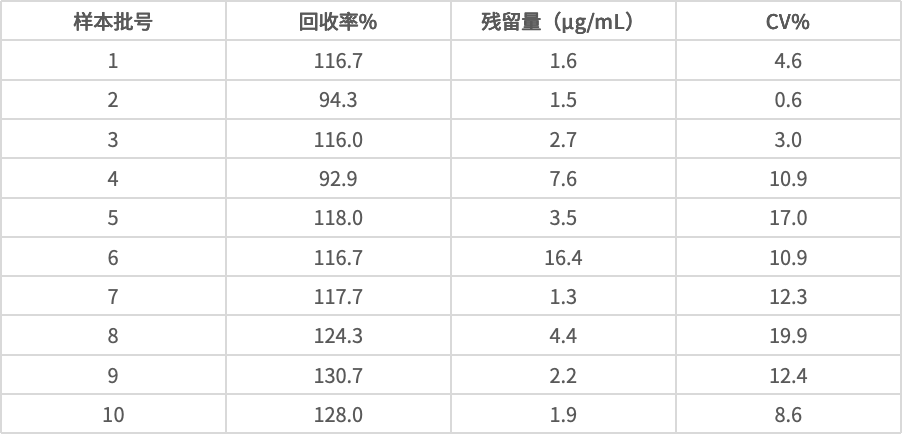
根据《美国药典》42版 通则509及2020版《中国药典》通则3407要求:标曲R2大于0.98,斜率-3.8~-3.1;样本可接受标准:加标供试样品回收率应在50%~150%;加标供试样品检测值的CV%应不大于30%。
扩增曲线与标曲图:
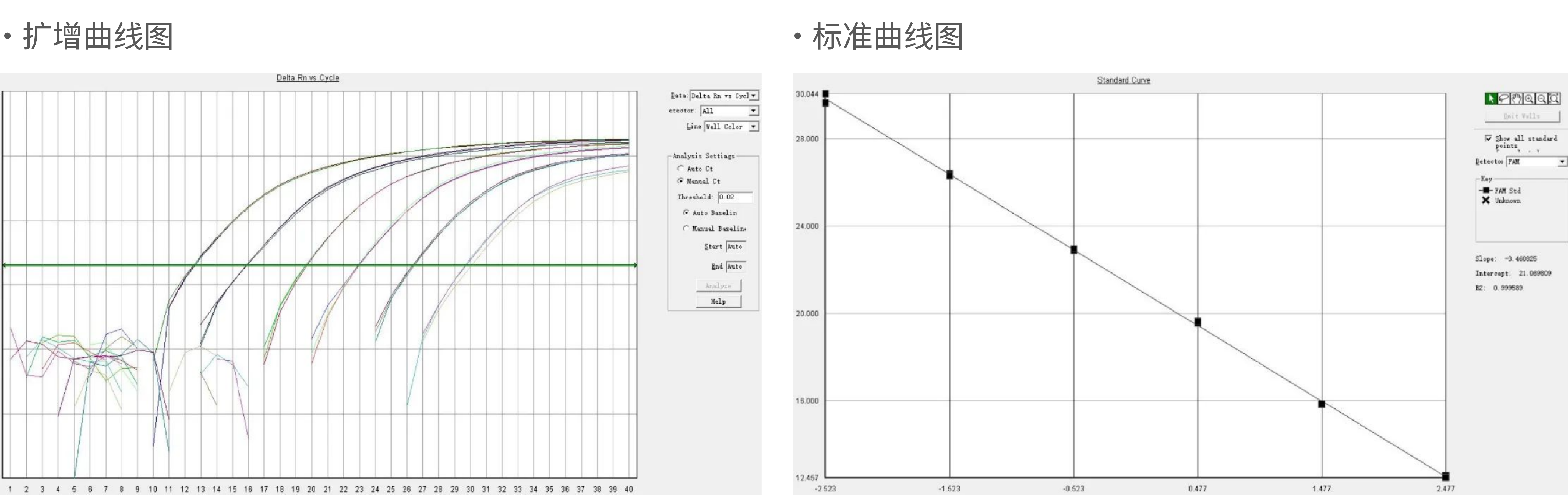
R2和斜率符合《中国药典》和《美国药典》的要求。