产品中心
腺相关病毒(AAV)是一种直径约25 nm的无包膜微小病毒,包含一个4.7 kb的单链DNA基因组,现已鉴定出13种AAV血清型,可以感染多种组织类型的细胞。这些血清型的AAV载体由于缺乏致病性、具有广泛的传染性和介导稳定高效基因表达的能力,已成为表达治疗性基因产品的常用载体。迄今为止,美国和欧盟已经批准了三种基于AAV载体的产品用于治疗罕见基因疾病,还有许多用于单基因和非基因疾病的其他产品正处在开发阶段。
AAV产品质量控制及相关法规:
为了规范和指导基因治疗产品按照药品的研发规律和管理规范进行研究,大力推进以AAV载体为主的基因疗法开发,FDA于2018年发布了6项新的基因治疗指南;今年5月,国家药品监督管理局药品审评中心(CDE)发布《体内基因治疗产品药学研究与评论技术指导原则》。
根据FDA及CDE针对人类基因治疗新药应用研究在化学、生产和控制的指导文件,检测项应提供相关产品的无菌性、稳定性、纯度、效价和同一性的信息。在这些需要确定的信息中,衣壳装载率指标对AAV载体滴度和纯度存在很大影响。衣壳装载率反映了遗传物质被包裹到病毒衣壳中的效率,它不仅影响AAV产品的效力,还会在患者体内产生免疫原性,可能给患者带来致命风险。因此,AAV载体衣壳装载率作为产品的关键质量属性(CQA)之一,在基因治疗产品的质量控制中尤为重要。
AAV载体衣壳装载率的质控检测方法
衣壳装载率的定量检测是基因治疗产品表征的一个重要方面,可以通过不同方法来测定,如透射电子显微镜法(TEM)、分析超速离心法(AUC)、毛细管凝胶电泳(CGE)、毛细管区带电泳(CZE)、分子排阻色谱-多角度激光光散射法(SEC-MALLS)、实时荧光定量PCR(qPCR)、酶联免疫吸附实验(ELISA)、光密度法(OD)、阴离子交换色谱(AEX)和液相质谱分析法(LC-MS/MS)等。在现有技术中,AUC是金标准,但与AUC方法相比,TEM、CGE、CZE、SEC-MALLS、AEX和LC-MS/MS也各具有优势,即遵循GMP合规性或具有更高的通量。
• 透射电子显微镜法(TEM)
TEM法是观察AAV载体衣壳装载率一种直观可靠的方法(图1),可对衣壳结构表征进行基于图像的形态学评估。该方法可用于杂质的可视化,如蛋白酶体或破损的病毒衣壳,但是无法进行准确定量,且图像易受聚集物、杂质等的影响,包括细胞碎片、破碎颗粒、残留DNA及20S蛋白酶体核心的污染等。
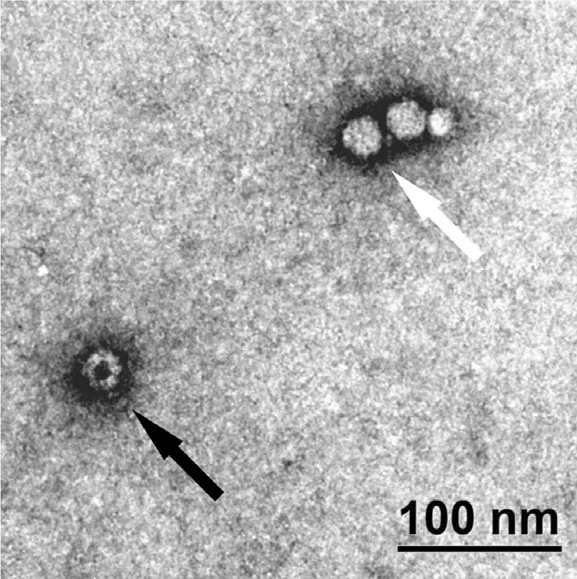
图1 AAV矢量的TEM图像 :完整的(明亮的球;白色箭头)和空的(颜色较深的球体;黑色箭头)衣壳
• 分析超速离心法(AUC)
该方法根据AAV衣壳的大小和重量,以及在AUC过程中特有的沉降系数,可实现空的、满的、部分填充的和过度填充的AAV衣壳的彼此分离,被认为是评价AAV衣壳装载率和产品特异性杂质分析的金标准。AUC能够全面反映样品的非均质性,可用于测定空衣壳、部分填充衣壳、填充衣壳和过填充衣壳的相对数量。与此同时,提供了完整衣壳和空衣壳之间的最佳分辨率,能够分离部分装载的载体(图2)。
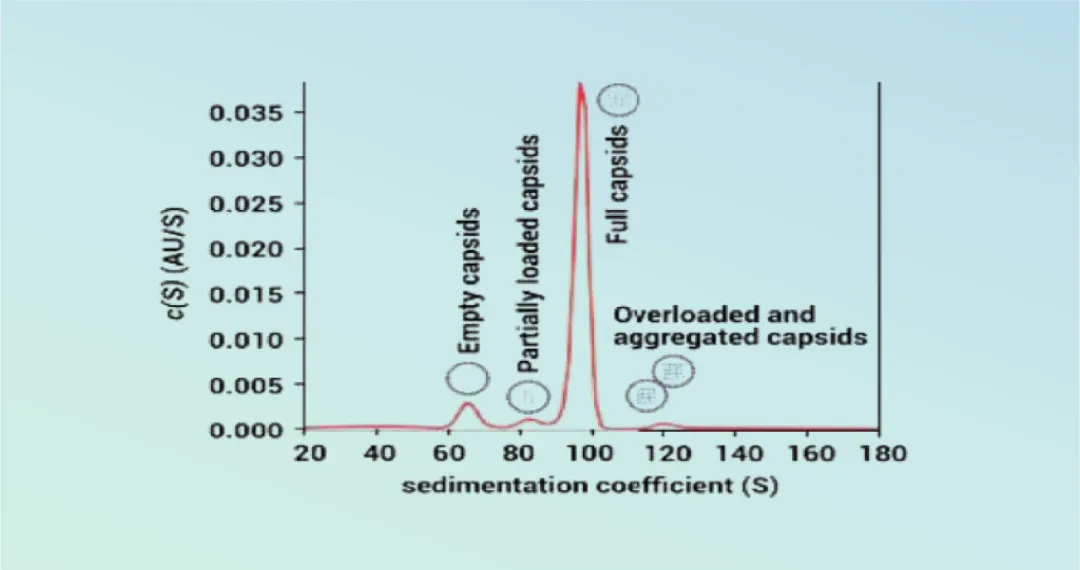
图2 AUC方法下空、部分和满衣壳分布图
AUC实验可在广泛的条件下进行,且对样品的干扰最小,能够在分析后恢复AAV样品,在样品数量有限时具有明显优势。但AUC最大的缺点在于通量低、周转时间长、对测试样品的量和纯度要求高,同时检测时无法分辨参入AAV载体中核酸的种类及是否为多聚体。
• 毛细管凝胶电泳(CGE)
该方法可以克服AUC检测方法的缺陷,具有简单、可靠的一步样品制备工作流程,可获得一致标记和变性的病毒蛋白样品并进行分离和定量。具有较高的灵敏度,适用于多种AAV血清型衣壳蛋白纯度分析。
此外,CGE的结果与AUC具有可比性和互补性,可作为透射电镜法(TEM)和分析超离心法(AUC)的补充。
• 毛细管区带电泳(CZE)
CZE法可通过评估信号强度来获得总基因组浓度的信息,以此来量化核酸种类,从而得到与基因组滴度相关的结果。CZE样品制备简单,不需要进行纯化,但该方法目前研究较少,仍处于起步阶段。
• 分子排阻色谱-多角度激光光散射法 (SEC-MALLS)
SEC-MALLS法结合紫外检测器(UV)和示差折光检测器(RI)检测,可以获取样品不同AAV种类、分子量和浓度的聚集以及降解的信息,计算衣壳装载量、纯度和杂质含量(如聚集体和降解产物)以及AAV样品的大小和颗粒数。SEC-MALLS是一种简单、准确性高的方法,可广泛用于表征AAV衣壳的各项关键物理属性。
该方法不需要使用标准曲线即可直接测量AAV的Cp/Vg和滴度,并且可替代传统方法测定轻质与重质衣壳比。通过利用衣壳及其包裹DNA的固有吸光度,光散射和折射特性,可以将原始SEC-MALLS数据转化为各种血清型衣壳以及包裹DNA的关键属性定量。与AUC和电子显微镜(TEM)相比,提供了更高的分析通量,可以作为QC环境中的放行方法,或用作快速筛选工具,以支持工艺开发和产品的质量评估。
• 阴离子交换色谱法(AEX)
阴离子交换色谱法可用于不同AAV血清型的分析,并有效解决AUC在检测时样品量需求较大及实验通量低等问题,具有良好的线性、准确性和精密度,仅需几微升的样品即可轻松实现高通量分析的自动化,无需进行样品制备,且具有符合GMP要求的软件。
• 液相质谱分析法(LC-MS/MS)
尽管分析超速离心(AUC)和阴离子交换色谱(AEX)用紫外或荧光检测定量等传统方法可以成功分离各种血清型的空衣壳和完整衣壳,但基于吸光度的方法仍然面临一定的局限性:即在处理低浓度的AAV样品时灵敏度不足。基于质谱的天然方法,在不需要过多样品制备的情况下,可以评估空的和满的AAV衣壳的比例。
另外,电荷检测质谱(CDMS)通过直接测量单个离子的质量,使其能够在以前不可能的水平上分析高分子量病毒颗粒且不受样本基质复杂性的限制(图3)。利用液相质谱成功对AAV5和AAV8样品中空衣壳相对量的快速测定,证明了原生质谱在病毒颗粒表征方面的潜力。
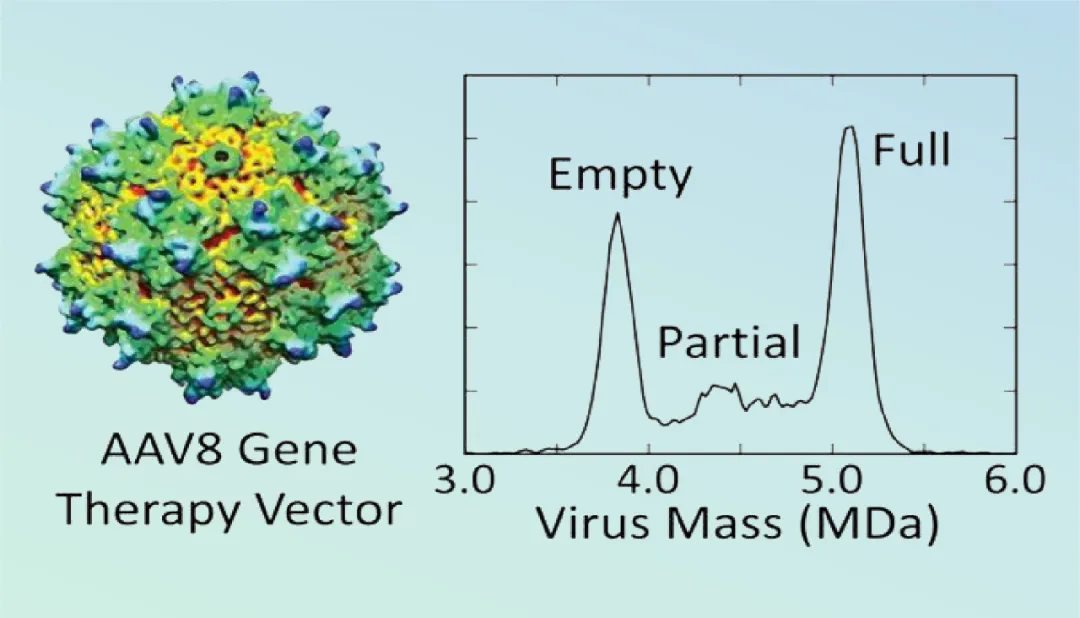
图3 AAV3D模式图像(完整、部分和空的衣壳)
总 结
与传统的蛋白类生物制剂如单克隆抗体相比,AAV载体作为下一代生物制剂的复杂程度要高得多。现有的AAV空颗粒和全颗粒的定量方法存在一定局限性(见表1),阻碍了其在批次放行或表征方面的广泛应用,依赖单一分析技术存在因检测结果不准确导致的产品质量风险。
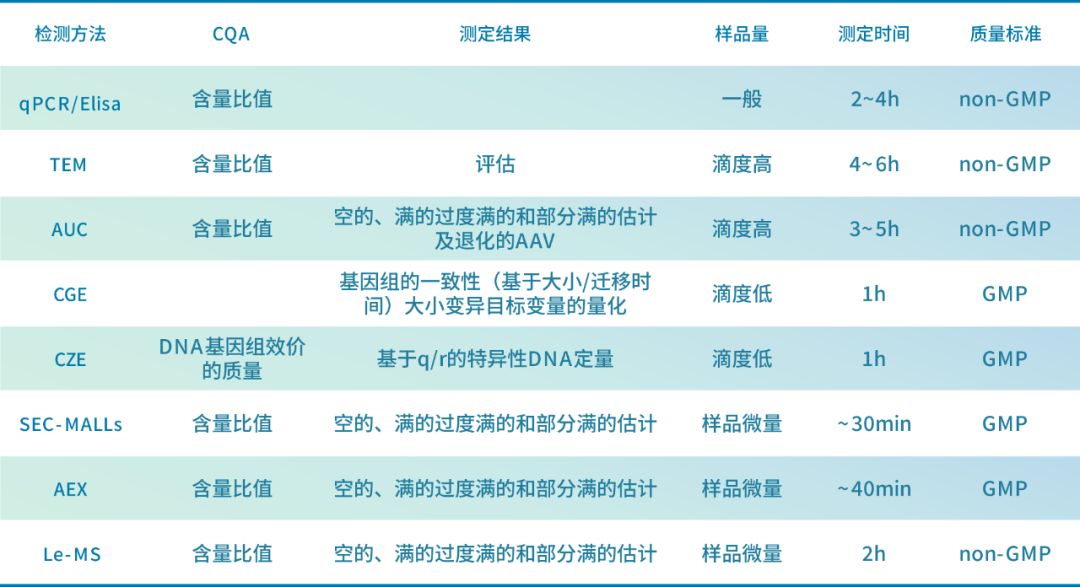 表1 AAV载体衣壳装载率检测方法比较
表1 AAV载体衣壳装载率检测方法比较
因此,AAV载体衣壳装载率分析需综合,考虑采用全面分析策略来评估与衣壳填充有关的潜在CQA。随着现有技术的进一步发展和改进,特别是基于毛细管电泳和质谱分析的方法(更易实现自动化,可在低样本量的条件下,快速提供准确的分析结果,满足GMP相关要求),可助力基因治疗企业对于产品的质量控制和产品放行。
参考文献:
[1] Samulski RJ, Muzyczka N. AAV-Mediated Gene Therapy for Research and Therapeutic Purposes. Annu Rev Virol. 2014;1(1):427-51.
[2] HAMMON RWABCCWM. Adenovirus-associated defective virus particles. science. 1965;149.
[3] Strasser L, Morgan TE, Guapo F, Fussl F, Forsey D, Anderson I, et al. A Native Mass Spectrometry-Based Assay for Rapid Assessment of the Empty:Full Capsid Ratio in Adeno-Associated Virus Gene Therapy Products. Anal Chem. 2021;93(38):12817-21.