产品中心
生物制品病毒污染一直是药企和监管机构重点关注的生物安全性评价内容,近年来报道了多起病毒污染事件,主要发生在细胞、疫苗、血液和血浆制品等新型生物制品[1]。这种污染不仅会给产品的预防及治疗效果造成影响,还可能对生物制品的生产环境和操作者带来潜在污染与健康风险。因此,需要使用合适的检测技术对生物制品中的病毒污染进行鉴定及检测,方法包括PCR法、细胞培养法等。然而,不同病毒检测方法均存在一定的优势和局限性,例如:
• 体外病毒(IVV)检测:能够检测各类病毒,并被用作质量控制(QC)在cGMP生产中释放试验,但会出现漏检,且培养周期长;
• qPCR方法:可快速准确地鉴定已知病毒,同样可用作质量控制(QC)在cGMP生产中释放试验,但需要已知病毒序列进行引物设计,对未知的潜在危险病毒无法鉴定;
• 电镜观察(TEM):可清晰直观地呈现病毒的特征,但对病毒纯度要求高,检测下限有限,同时易被其它物质干扰;
• 血清学检测:操作相对简便,但容易出现假阴和假阳性结果;
• 病毒基因组测序、RNA指纹、蛋白质谱及大规模平行测序技术(NGS):具有通量高、灵敏度高、检测范围广、时间周期相对短等优势,但实验要求技术强,程序复杂,目前缺少相应的QC控制等。
有研究[2]测试并统计了细胞培养(表达相应药物)过程中(初始检测和最终确认)出现外源病毒污染事件的数量,并在每个事件中使用了多种方法进行测试,发现不同方法鉴定、检测病毒的结果并不一致。因此,生物制品中病毒污染检测不能仅依靠上述提到的某一种方法单独进行,应几种方法配合使用进行多重验证。
Methods used for the detection (both initial detection and confirmation of a contamination) andidentification of the viral contaminant of a virus contamination in cell culture operations
| Methods | Detection | Virus identification | Used for QC test | QC test positive | QC test negative |
| PCR | 8 | 11 | 1a | 1 | 0 |
| IVV test | 7 | 14 | 11b | 4b | |
Electron microscopy | 4 | 3 | |||
Viral genome sequencing | 3 | ||||
Immunofluor escence | 2 | 2 | |||
Mass spectrometry protein sequencing | 2 | ||||
RNA fingerprinting | 1 | 1 | |||
| Serology | 6 | ||||
Massively parellel sequencing | 1 | 1 |
The number of contamination events where each test was used is listed in each column; multiple tests may have been used in each event. Tests used for QC lot release, and whether they were positive or negative, are indicated. One company used both PCR and IVV tests for QC lot release; in one event, PCR was positive, but the IVV test was negative. One company found bioreactors to be positive by PCR but negative by IVV test, whereas other bioreactors were positive by both tests. This is counted in both columns.
表1 不同方法检测和鉴定病毒污染事件
法规和监管要求
2020版《中国药典》生物制品生产检定用动物细胞基质制备及质量控制中,针对细胞检定项目,明确规定主细胞库、工作细胞库和生产终末细胞均需根据细胞特性、传代历史、培养过程等情况进行病毒污染检测,并对检测方法选择作了如下描述:
病毒污染检测应结合品种特点和具体生产情况综合分析,设计并选择适宜的方法对潜在污染病毒进行检测,如细胞培养法、核酸扩增技术等。为提高病毒检出率,应尽可能采用先进的技术和方法用于病毒污染的检测。病毒检测阴性不能完全证明无病毒污染存在,应排除因取样量不足、病毒含量低于检测方法的灵敏度,或检测方法不适应等导致病毒检测结果阴性的情况[3]。
除此之外,国家药品监督管理局等监管机构对生物制品病毒安全性控制也提出了要求,内外源病毒因子检测已成为各类产品的必检项,国内外监管机构和法规也对病毒检测相继出示了法规和指导原则。
① ICH Q5A(R1):Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origen,1999.
② 血液制品去除/灭活病毒技术方法及验证指导原则(2002年)
③ 人用重组DNA制品质量控制技术指导原则(2003年)
④ 生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则(2005年)
⑤ USP 1051(40-35NF):Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal,2006.
⑥ 细胞治疗产品研究与评价技术指导原则(试行)(2017年)
指示细胞培养法、动物体内接种法、逆转录酶活性测定、透射电镜检查法、PCR法及其它分子检测技术等,其检查的种类和方法需根据材料的种属来源、组织来源、细胞特性、传代历史、培养方法及过程等确定,因此其检查易受产品制备过程中多种未知因子或不同处理方式的影响,造成检测方法不适用而导致的失败或漏检。传统的细胞培养法和动物体内接种法等由于实验时间周期长、通量小等局限性而越来越不适应新型生物制品的质控、放行需求。随着检测技术的不断更新发展,实时荧光定量PCR(Realtime fluorescence quantitative PCR, qPCR)和下一代测序技术(Next-generation sequencing,NGS)因其实验周期短、通量大等特点,已引起人们的广泛关注并处于不断发展中。
• qPCR法
作为正在兴起的分子检测技术,qPCR法在内外源病毒检测上能弥补体内外培养法的不足,其应用备受关注并在生物制品质控中的应用范围越来越广。qPCR法用于外源病毒污染检测,首先是在病毒数据库中筛选出高频发生且带来一定危害的污染病毒,然后在筛选出的病毒基因组或转录组上设计特异性高的引物与荧光探针,通过后续PCR扩增中的荧光信号值进行实时检测,同时在扩增系统中加入内参和阴阳性质控品对检测试剂、交叉污染等进行监控并做为对照,通过模板Ct值与起始拷贝数的线性关系进行定性和定量分析。
目前在外源病毒上开发的qPCR检测产品主要基于禽源、鼠源、牛源、猪源等已知种属特异性病毒,且大部分都是基于单病毒的检测,多病毒的检测尚处于探索中。针对未知病毒的检测,qPCR法仍存在无法克服的弊端。
• NGS法
NGS也称大量平行测序(MPS),是一种可以在较短时间内一次测定大量核苷酸序列的技术,理论上可以检测和鉴别所有已知或未知的DNA和RNA序列。与其他方法相比,其检测范围最广且灵敏度高。为解决未知病毒因子的漏检风险,欧洲药典和WHO推荐NGS法作为现有技术的可替代方法,特别是可取代动物体内实验。FDA没有特别提出NGS法但已在做尝试,日本药典和中国药典目前还未强调NGS法。NGS法检测外源病毒需要解决的问题是高背景下低含量病毒的检测,而且针对复杂的检测流程和分析流程需要有标准化的质控和严格验证。其流程包括样本收集、去宿主核酸、病毒核酸提取、病毒全基因组扩增、文库构建、测序、生物信息分析和阳性信号的多技术配合验证[4]。
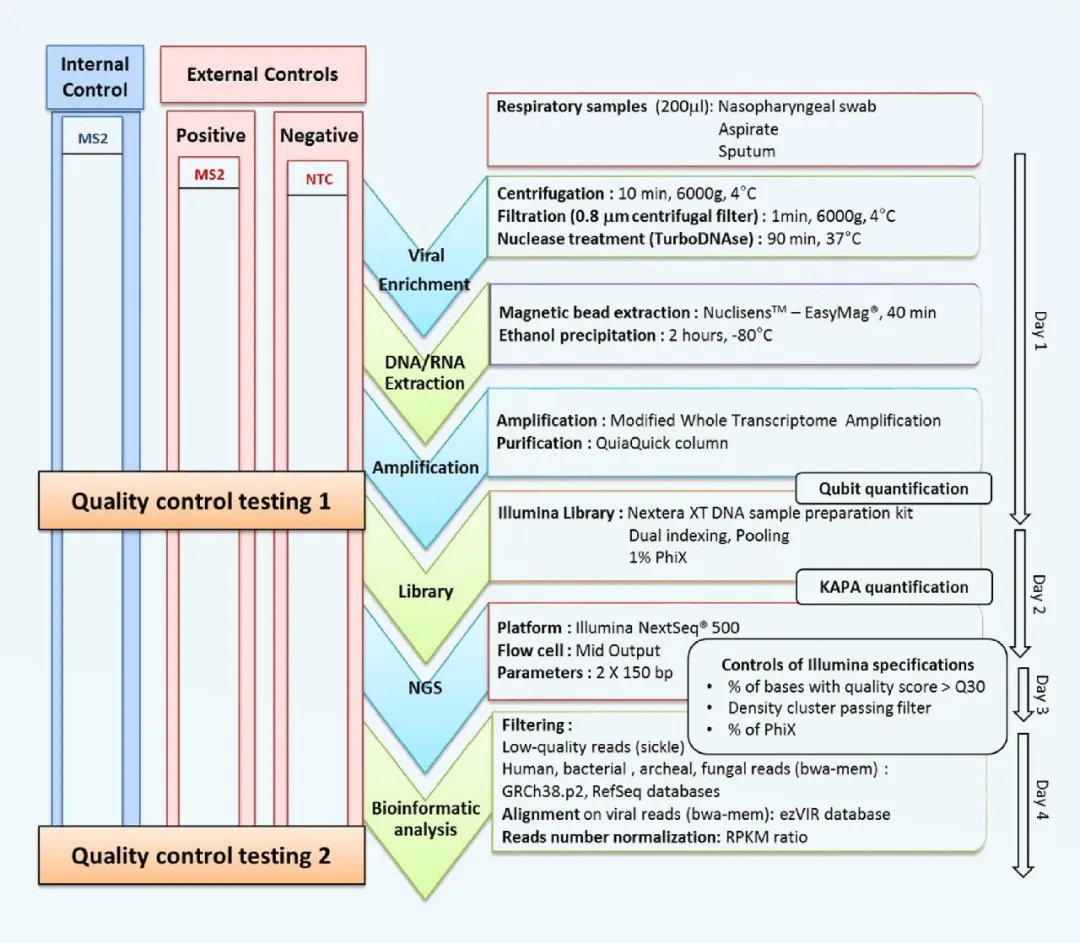
图2 外源病毒NGS检测流程
作为生物制品病毒污染检测新趋势,NGS需要重点考虑以下方面:
① 需要有一组充分标定的模式病毒标准品进行后续的标准化流程开发和验证,其考虑因素有病毒的基因组类型(DNA/RNA,单链/双链,线形/环状)、病毒基因组大小、有无包膜、病毒的浓度和比例等。
② 不同类型病毒基因组的抽提效率不同,需要评估抽提试剂对不同类型病毒的抽提偏向性,避免对最终结果造成漏检。
③ 宿主去除后外源病毒的含量较低且可能含有单链DNA病毒核酸,为满足后续的文库构建要求,需对核酸进行全基因组的扩增。要求扩增方法对病毒基因组扩增全面、偏向性低,且扩增效率高,操作简便。
④ NGS法检测范围广但可能出现假阳性,因此流程中需要包含内外质控品和严格的质控QC标准,通过对照实验尽可能的排除和控制假阳性结果。
⑤ NGS高通量测序后会产生大量的干扰信息,如何去除复杂的背景噪音避免假阳性和假阴性的出现,需要建立合理标准的生信分析流程。分析流程建立过程中同样需要建立严格的质控QC标准,并通过后期不同方法进行验证,确定其标准的真实性。
参考文献:
[1] Woliam R.Shek. Quality Control Testing of Biologics. The mouse in biomedical research, 2nd edition, Chapter 23.
[2] Paul W.Barone.et al. Viral contamination in biologic manufacture and implications for emerging therapies. Natyre biotechnology, Vol 38, May 2020, 563-572
[3] 中国药典2020年版(第三部),生物制品病毒安全性控制
[4] A.Bal.et al. Quality control implementation for universal characterization of DNA and RNA viruses in clinical respiratory samples using single metagenomic next-generation sequencing workflow. BMC infectious Diseases, (2018) 18:537