产品中心
宿主残留蛋白(HCP)作为生物制品生产过程中潜在的杂质,可能引发免疫反应,影响产品的安全性和有效性。[1-2]
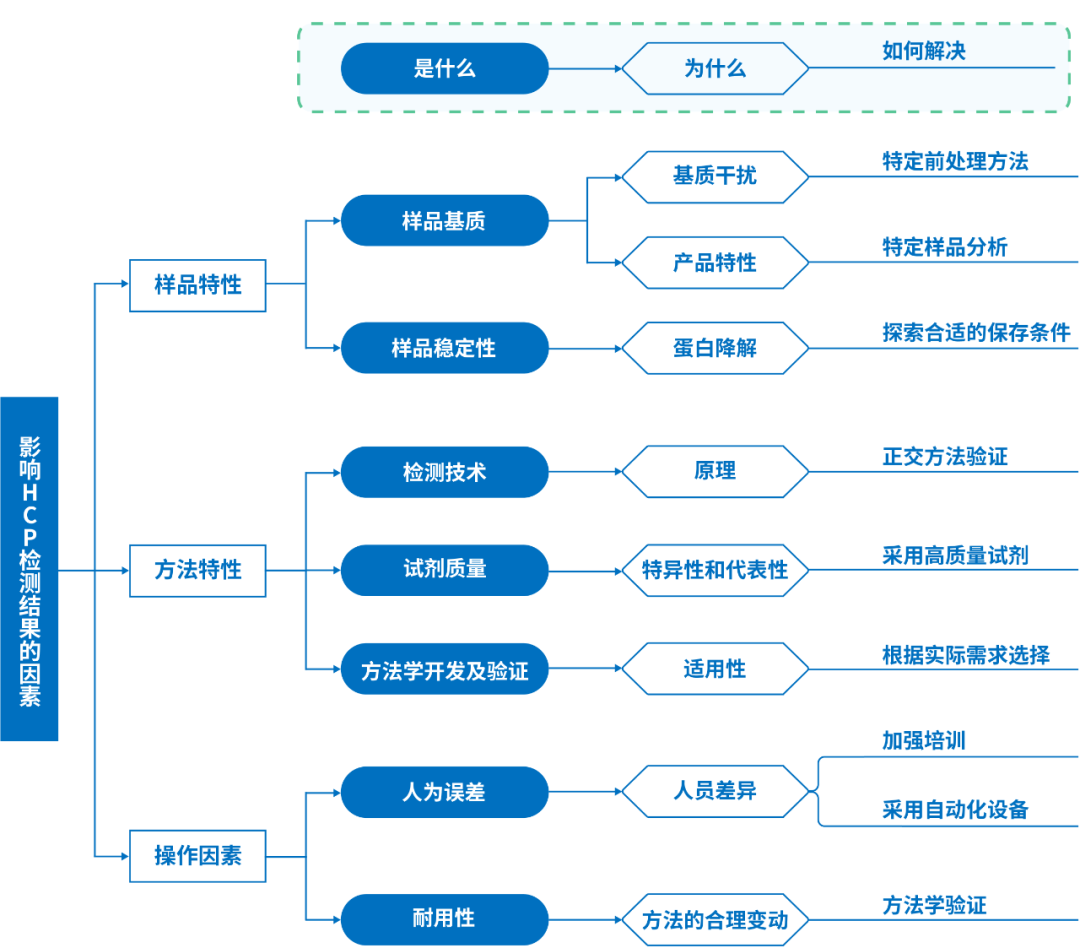
如何精准检测HCP?这不仅是法规的硬性要求,更是守护患者用药安全的核心防线。但检测结果常因样品、方法、操作等因素“飘忽不定”,稍有不慎便可能埋下隐患。今天,我们将深度剖析影响HCP检测结果的重要关键因素,帮您避开检测“雷区”。
样品质量是基础
1、样品基质
HCP检测贯穿生物制品生产的全过程,涉及收获、纯化、制备等多个步骤。在不同样品基质下,HCP检测可能存在巨大差异。例如,对于含有佐剂的疫苗,由于佐剂的干扰,难以在成品中对HCP项目进行检测,因此一般在吸附工艺之前的原液阶段进行检测。[3]
2、样品处理与保存
样品的收集、处理和保存方式对检测结果至关重要。不正确的处理可能导致蛋白降解或变性,从而影响检测结果。例如,若采用历史批样品作为内部质控品,应结合其稳定性数据合理制定保存条件及保存期限,以保证检测方法的准确性和稳定性。
方法选择是关键
1、检测技术原理
酶联免疫吸附法(ELISA法)和液相色谱-质谱联用方法(LC-MS法)是目前HCP检测的两大常用方法。文献统计显示,目前对于总HCP定量,ELISA仍是主流方法;MS法作为对特定蛋白(例如,高风险蛋白)的鉴定和定量,已成为重要的互补手段。[4-6]
2、试剂与耗材质量
检测过程中使用的试剂和耗材的质量直接影响检测结果的准确性。低质量的试剂可能导致假阳性或假阴性结果。例如,抗体的特异性和亲和力不足,可能导致ELISA检测中的交叉反应;抗原代表性不强或是抗体覆盖率低,可能会导致漏检;稀释液抗干扰能力弱,可能影响检测准确性。
案例研究表明,采用定制化方法替代原有商业化试剂盒后,抗原代表性和抗体覆盖率明显提高,HCP检测值整体升高。[7]
3、检测方法的验证
通过稀释线性实验,确定样品的最低需求稀释度(MRD)。目前,行业内主流有计算方式有两种,应根据特定样品类型及申报条件选择合适的稀释线性计算方法。[5,8]
操作规范是保障
1、人员操作规范
一方面,实验人员的专业技能和经验对检测结果的准确性有很大影响。熟练的实验人员能够准确地进行样品处理、试剂配制和仪器操作,减少人为误差。
另一方面,一个合理的HCP检测方法,在开发及应用时,应当考虑操作的合理变动区间(即耐用性)并设置相质控,从程序上尽量消除人为误差对结果的影响。
2、操作流程标准化
严格遵循标准操作流程(SOP)是确保检测结果可靠性的关键。操作步骤的不规范可能导致结果的重复性差或误差增大。目前,市面上已有全自动化HCP ELISA检测系统(←点击查看),可以完成从样品制备、孵育、洗板至数据采集等一系列操作,结合实验室信息管理系统(LIMS),可以实现“输入即输出”,减少流程误差。[9]
综上所述,影响宿主残留蛋白检测结果的因素贯穿于检测全过程,每一个环节都可能对最终的检测结果产生影响。
湖州申科建立了多种HCP检测分析技术平台,涵盖商业化试剂盒、平台型试剂盒开发、抗体覆盖率验证、靶向质谱技术、方法学验证及常规样品检测、全自动ELISA设备系统等,应用于保障生物制品的质量、安全性等多个关键质量属性,从而更好地守护患者的用药安全,推动生物制药行业的健康发展。
参考文献
[1] Tuameh, A., Harding, S. E., & Darton, N. J. (2023). Methods for addressing host cell protein impurities in biopharmaceutical product development. Biotechnology Journal, 18, e2200115.
[2] Bracewell, D.G., Francis, R. & Smales, C.M. (2015), The future of host cell protein (HCP) identification during process development and manufacturing linked to a risk-based management for their control. Biotechnol. Bioeng., 112: 1727-1737.
[3] 李敏,常卫红.生物制品质量标准研究与建立一般原则的探讨[J].中国新药杂志,2017,26(16):1887-1893.
[4] Jones, M. , Palackal, N. & Wang, F, et al. (2021). “High-risk” host cell proteins (HCPs): A multicompany collaborative view. Biotechnology Bioengineering. 118, 2870–2885.
[5] United States Pharmacopeia (2024). General Chapter, <1132> Residual Host Cell Protein Measurement in Biopharmaceuticals. USP-NF. Rockville, MD: United States Pharmacopeia.
[6] United States Pharmacopeia (2025). General Chapter, <1132.1> Residual Host Cell Protein Measurement in Biopharmaceuticals by Liquid Chromatography-Mass Spectrometry. . Rockville, MD: United States Pharmacopeia.
[7] 李怡君,寇雅真,魏开坤,等.生物制品生命周期管理中分析方法变更的审评考虑和案例研究[J].中国新药杂志,2024,33(11):1102-1108.
[8]https://www.cygnustechnologies.com/resources/guidelines/
[9]https://www.shenkebio.com/product/2254.cshtml