产品中心
嵌合抗原受体T细胞(CAR-T,Chimeric abtigen receptor T cell)是指利用基因修饰技术,将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞中,使T细胞通过与肿瘤细胞表面的特异性抗原相结合而激活,从而达到治疗肿瘤的目的。
目前有多种方法用于T细胞修饰及CAR-T细胞产品制备,包括病毒载体转导(如γ-逆转录病毒载体或慢病毒载体)及非病毒载体转染等,目前已开展的临床试验中以病毒载体转导的方式为主。
慢病毒( lentivirus)载体:
慢病毒载体是以人类免疫缺陷Ⅰ型病毒(human immunodeficiency virus,HIV-1)为基础发展起来的基因治疗载体,属于逆转录病毒家族,又区别于一般的逆转录病毒载体,比逆转录病毒载体具有更强的感染能力,具有容纳外源性目的基因片段大、稳定整合、持久表达、免疫反应小等优点,是最常用的基因转移载体。
而载体作为基因治疗的工具,可能带来插入突变、复制型病毒、外源因子污染等风险,同时其携带的遗传物质是CAR-T细胞的重要组成部分,是使T细胞具有强大的识别和杀伤肿瘤细胞活性的重要基础,考虑到病毒载体技术的广泛应用,具有复制能力的慢病毒/逆转录病毒检测成为重要问题,FDA及欧盟先后出台相关文件,要求建立灵敏、可靠的RCL/RCR检测方法。
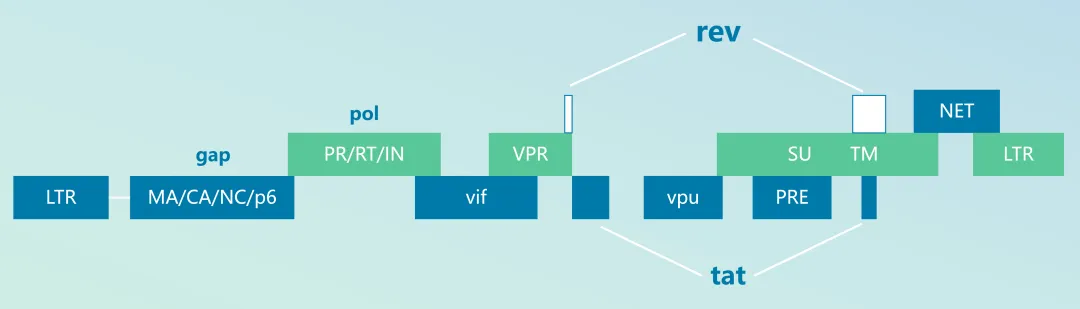
图1 慢病毒基因组
HIV病毒基因组由两条正义链的RNA组成,约9kb的序列编码了9个蛋白,分别是gag、pol、vif、vpr、vpu、env、tat、rev、nef。其中三个最大的阅读框编码了三个最主要的结构蛋白:gag、pol和env
gag:包含组成病毒中心和结构的蛋白质的基因(Gag, group specific antigen)
pol:包含逆转录酶的基因(Pol, polymerase)
env:包含组成病毒外壳的基因(envelope)
(gag、pol、env是逆转录病毒的三个基本结构基因)
复制性慢病毒/复制性逆转录病毒
RCL/RCR风险:
• RCL/RCR会同逆转录病毒载体一样,整合在细胞基因组中,从而产生因整合导致的原癌基因激活,抑癌基因破坏或者使促细胞生长的因子高度表达而造成二次肿瘤的风险。
• 因其具有复制性,即产生具有复制能力的病毒,增加了因整合而造成的二次肿瘤的风险。
RCL/RCR产生的原因:
慢病毒载体来源于病原体HIV-1,为了保证产品的安全性,目前基因治疗产品所用的慢病毒载体/逆转录病毒载体均为非复制性。通过将基因组中的辅助蛋白删除,并将结构基因分别通过3-4个质粒系统进行分别包装,形成三质粒系统或者四质粒系统,如图1所示,极大的降低了产生具有复制能力慢病毒的可能性,这意味着至少需要2-3次完整的重组时间才能产生一个具有复制能力的慢病毒,在此基础上进一步修饰改造,构建自失活的慢病毒载体(SIN),极大的提供包装病毒的安全性,此外使用VSV-G蛋白取代env蛋白增加载体的稳定性及受体细胞范围。
RCL/RCR产生的主要原因是转移载体和包装载体同源序列的重组。随着新的载体系统的发展与应用,载体系统中各元件之间发生同源重组的变化导致 RCL/RCR生成机制和结构的变化愈加复杂。而且,重组不仅限于载体系统之间各组分发生的重组,也包括载体成分和细胞基因组之间的重组。
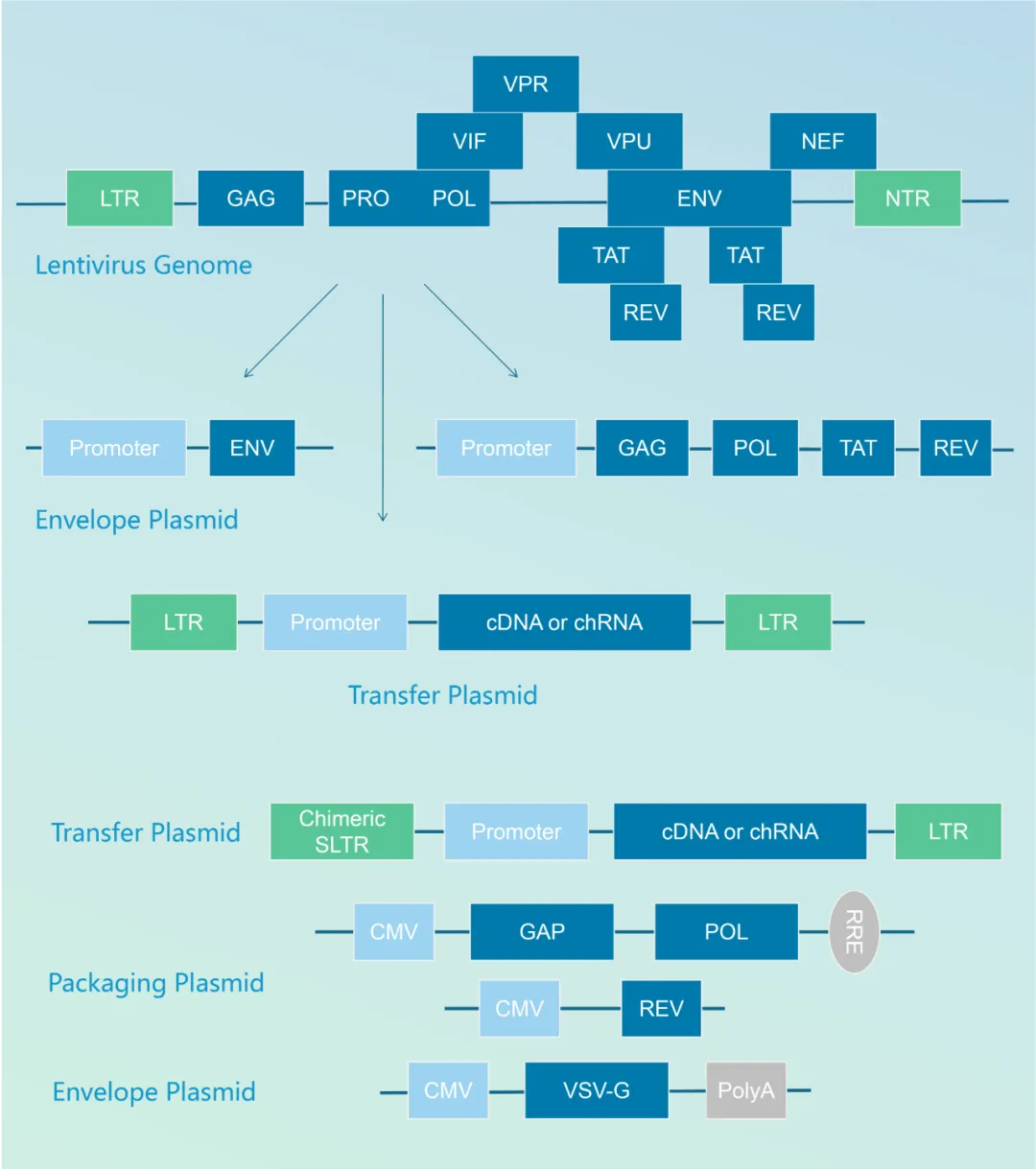
图2 HIV-1基因组→三质粒系统→四质粒系统
复制性慢病毒/复制性逆转录病毒检测
RCL/RCR检测的阶段:
虽然通过上述病毒制备体系的改进,很大程度上降低了RCL/RCR产生的风险,但是仍不能完全排除,美国FDA要求对于γ-逆转录病毒载体和慢病毒载体,需要在整个生产过程及不同阶段进行RCL/RCR检测,需要对载体生产用主细胞库、工作细胞库、生产终末细胞、载体上清液及在体外培养超过4天的载体转到细胞进行检测,如图3所示:
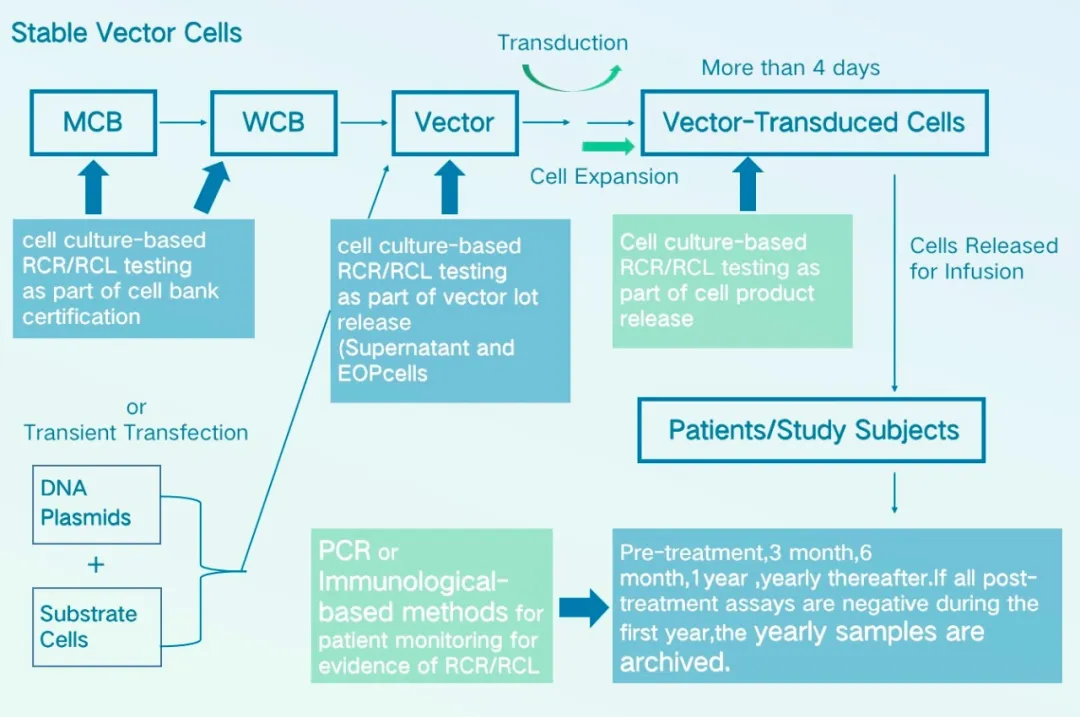
图3 RCL及RCR检测取样
RCL/RCR检测的方法:
FDA推荐的RCL检测方法是利用敏感细胞对病毒载体中可能存在的RCL进行培养扩增,并在培养终点进行检测。
共培养测定法:
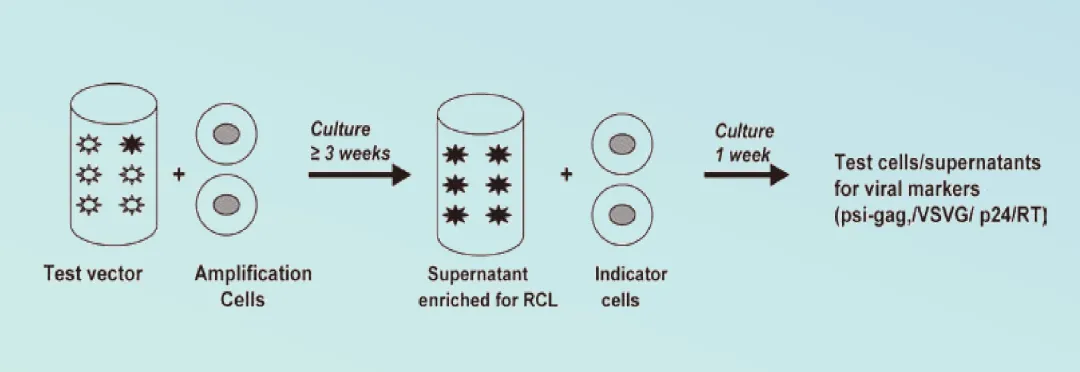
图4 RCL测试
• 扩增期:将待测物与对HIV-1易感并且可大量扩增病毒的细胞系( 通常用 C8166) 孵育,细胞传代 5 次以上,培养至少3周。
• 指示期:3 周后收集培养上清,接种于C8166 细胞中培养 7d 后检测RCL 标志物。
• 检测:
A:P24 ELLISA 的方法:适用于由载体制备过程中病毒基因组之间的重组形成 RCL 的检测。
B:PERT法:当 RCL 进行扩增后,也可应用PERT 检测方法测定逆转录酶活性。该方法的缺点是在某些细胞中存在高背景。
C:qPCR方法:采用实时定量 PCR 方法( Q-PCR) 测定假型病毒 VSV-G 复制过程中的 VSV-G 基因序列或检测由载体质粒和包装质粒重组产生的psi-gag序列。
qPCR快检法
目前许多 CAR-T企业采用 Q-PCR方法直接测定CAR-T终产品中的 VSV-G 序列或 psi-gag 序列,因考虑到CAR-T细胞种产品一般需要新鲜输注的特殊情况,基于细胞培养法的RCL/RCR检测方法周期较长,建议在细胞产品制备过程中进行全面控制(如对慢病毒载体及生产终末细胞采用基于细胞培养方法测定 RCL/RCR,以确保生产工艺过程中不存在 RCL 的风险) ,细胞终产品阶段可采用qPCR快检测法快速放行。