产品中心
概念解读:生物工程类小分子药物一般指的是使用工程菌(如放线菌、细菌与真菌等)通过生物工程途径生产的分子量不大于5K Da的药物,如抗生素、免疫抑制剂等。另外,利用菌转化反应对化学方法难以实现的中间体进行生物合成,再结合化学方法通过新的合成路线得到的半合成类药物,都属于这个范畴。
行业发展:近年来,利用生物工程技术生产的大分子药物蓬勃发展,然而许多临床案例发现,药物的副作用并非来自于药物本身,而是由宿主菌/细胞核酸或蛋白残留引起,针对这类生物杂质的分析和检测已获得行业的广泛关注。生物工程类小分子药物生物杂质风险也随之引起重视,尤其是这类药物很多都是以注射的形式直接进入人体,产生立即性过敏反应的风险可能性更高。
检测方法:传统检测化学药物杂质的方法并不适用于生物杂质检测,对生物工程类小分子药物生物杂质分析解决方案提出了高难度挑战。除核酸、蛋白等生物杂质外,发酵生产过程中的工艺添加物,如用来当作碳源的葡萄糖等,存在未去除完全而残留的可能,也是产品质量控制的重要考量。
法规要求
各国法规尚未“明确”指示生物工程类小分子药物生物杂质(核酸、蛋白、糖类)相关检测方法及限度要求。最可以作为参考的应该是2012年欧洲药品管理局(EMA)制定的抗生素相关杂质质量标准设置(Guideline on setting specifications for related impurities in antibiotics)中针对经由发酵工艺生产的抗生素中杂质质量控制相关规定:与化学合成相比,发酵工艺中包含不易预测、控制且复杂的生物系统,所以形成相关的杂质分布更广、更复杂。生物工程类小分子药物参考其相关规定中的阀值(见表1-2)逐渐成为质控检测领域研究人员的初步共识。
表1. 人用抗生素活性物质阀值表
| 活性物质 | 半合成 | 发酵,单一 | 发酵,多组成 | 多肽 |
| 报告阀值 | 0.05%/0.03%* | 0.10% | 0.10% | 0.10% |
| 鉴定阀值 | 0.10%/0.05%* | 0.15% | 0.15% | 0.50% |
| 界定阀值 | 0.15%/0.05%* | 0.15% | 0.50%**/0.2% | 1.0% |
* (≤2克/天) / (>2克/天)
** 根据定义与结构密切相关的杂质
表2. 人用抗生素产品阀值表
| 活性物质 | 半合成 | 发酵,单一 | 发酵,多组成 | 多肽 |
| 报告阀值 | 0.1% | 0.15% | 0.15% | 0.1% |
| 鉴定阀值 | 0.2% | 0.2% | 0.2% | 0.5% |
| 界定阀值 | 0.2% | 0.2% | 0.50%**/0.2% | 1.0% |
** 根据定义与结构密切相关的杂质
注:报告阀值 - 超过此限度杂质必须被报告。
鉴定阀值 - 超过此限度杂质即需要被定性。
界定阀值 - 超过此限度杂质需要被定量。
宿主菌残留核酸检测
目前市面上常见的生物工程类小分子药物,其生产用宿主菌往往不是生物工程常用工程菌:如用于生产硫酸庆大霉素的小单孢菌,生产雷帕霉素用游动放线菌以及生产达托霉素的玫瑰孢链霉菌等。因此,通用型商品化残留核酸检测试剂盒对该类药物的宿主菌核酸残留检测并不适用。
自2012年创立以来,湖州申科长期专注于生物制品宿主残留检测领域,至今已自主开发并上市二十余款宿主残留核酸(DNA&RNA)标准化检测试剂盒,并已通过ISO 135485体系认证,将研究用试剂盒质量标准提高至医疗器械等级,保证持续、稳定的供应链输出。
针对生物工程类小分子药物,湖州申科可提供宿主菌残留核酸qPCR检测试剂盒定制服务,试剂盒经过全面性能验证,包括中间精密度、定量限、范围、准确性、重复性与专属性。针对客户提供的真实样品,同步完成符合美国药典<509>与中国药典<3407>的方法适用性验证,相关接受标准见表3。
表3. 方法适用性验证接受标准
| 项目 | 接受标准 |
| 阴性对照液 | 阴性对照品的Ct值不少于标准曲线最低浓度的Ct值 |
| 灵敏度 | 标准溶液最低浓度(标准曲线最低一个点)的Ct值不大于39 |
| 线性 | 标准曲线回归系数不低于0.98,斜率在-3.1~3.8之间 |
| 准确性 | 三个重复阳性对照样品的平均回收率在50~150%之间 |
| 相对标准差 | 检测样品三复孔之间不大于30%;阳性对照品三复孔之间不大于30% |
外源性总蛋白检测
目前生物工程类小分子药物以抗生素为主,且多以注射给药的方式,残留的宿主菌蛋白如未去除完全,存在免疫反应等风险。由于其拥有小分子药物的特性,不像大分子药物需要对应的宿主蛋白抗体才能完成蛋白残留的检测。这类抗生素药物通常拥有化药的性质,相对而言易溶于有机溶剂中,与外源性蛋白分离且不会与考马斯亮蓝染料相结合,故可使用蛋白沉淀加Bradford法来完成外源性总蛋白检测。
少部分抗生素药物不易溶于有机溶剂中,可采用超滤法,利用超滤膜的不同孔径与材质,将药物与外源性蛋白分离,针对外源性蛋白部分使用Bradford法检测。另外还有些药物结构由数个氨基酸构成(如达托霉素),虽然可以利用分子量大小来区分,但因氨基酸易与外源性蛋白形成氢键后聚集的特性,导致无法利用超滤法将其分离;此类药物也会与考马斯亮蓝结合,故无法简单的使用Bradford法检测,需考虑采用其它检测方法。
针对外源性总蛋白检测,湖州申科根据多年方法开发与项目积累经验,针对不同生物工程类小分子药物的特性,采用全面分析策略及“定制化”检测方法(见图1),并遵循中国药典<9101>对开发出的定量检测方法进行验证。
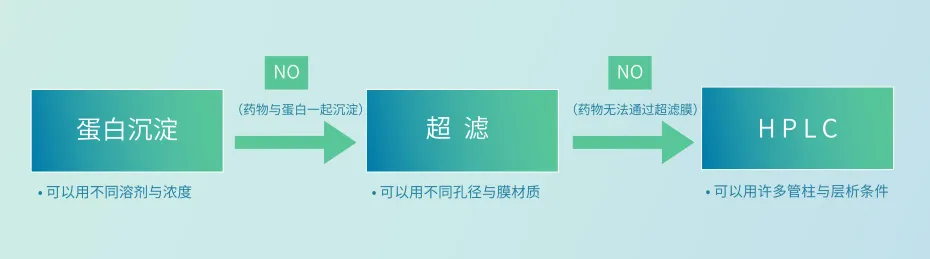
图1. 外源性总蛋白分析策略
外源葡萄糖总量检测
葡萄糖在发酵工艺中主要提供碳源,同属于药物中的生物杂质。由于在生产工艺中每种药物工艺添加与产生的物质不同,导致每个样品前处理过程需进行针对性开发。
湖州申科开发了针对各种类型样品的前处理方法,结合液相串联质谱技术 (LC-MS/MS) 分析此类药物活性物质中的外源葡萄糖含量,并遵循中国药典<9101>对开发出的定量检测方法进行验证,方法检出限可达到10ppm以下。
总 结
生物工程类小分子药物在整个药品市场使用量具有较高占比,如根据其生产工艺进行归类,此类药物亦属于生物制剂范畴。因此,宿主菌的核酸、蛋白甚至总糖残留检测都是生物制品质控领域关注的检项。
湖州申科在生物制品质量控制领域始终保持先行者意识,集“自主研发,严格按法规验证,严格按质量体系生产”等于一体,从药品全生命周期管理角度切入,提供更全面的生物工程类小分子药物杂质分析解决方案,为产品质量保驾护航。